Samenvatting
Flendrie M, Van Riel PLCM. TNF-α-blokkerende geneesmiddelen voor de behandeling van reumatoïde artritis. Huisarts Wet 2010;53(9):468-73. De komst van TNF-α-blokkerende geneesmiddelen heeft de behandeling van reumatoïde artritis ingrijpend veranderd. Waar bij veel patiënten aanvankelijk controle van ziekteactiviteit het hoofddoel was, zien we nu een verschuiving naar het bereiken van een snelle en volledige remissie. Het percentage patiënten dat dit doel ook daadwerkelijk haalt door gebruik van TNF-α-blokkerende geneesmiddelen is echter nog laag. De unieke structuur en het werkingsmechanisme van TNF-α-blokkerende geneesmiddelen kunnen leiden tot specifieke bijwerkingen, bijvoorbeeld een verhoogd infectierisico. Dit blijkt onder andere uit observationele onderzoeken, opgezet om de effectiviteit en bijwerkingen van deze nieuwe medicijnen te monitoren. Dit artikel beschrijft aan de hand van een observationeel onderzoek de belangrijkste effecten en bijwerkingen van TNF-α-blokkerende geneesmiddelen. Kennis hierover is van belang voor artsen, zowel in de eerste als de tweede lijn, die in hun dagelijkse praktijk patiënten zien die een behandeling krijgen met een TNF-α-blokkerend geneesmiddel.
De kern
- Aan het behandelarsenaal van reumatoïde artritis zijn de afgelopen jaren TNF-α-blokkerende medicijnen toegevoegd. Hiermee is de ziekteactiviteit soms tot volledige remissie te brengen, ook bij patiënten bij wie de reeds bestaande middelen geen effect hadden.
- TNF-α-blokkerende medicijnen hebben een verhoogd risico op (ernstige) infecties en auto-immuunverschijnselen als bijwerking.
- Kennis van deze middelen en goede samenwerking tussen eerste en tweede lijn zijn essentieel voor een veilige behandeling van patiënten met reumatoïde artritis.
Inleiding
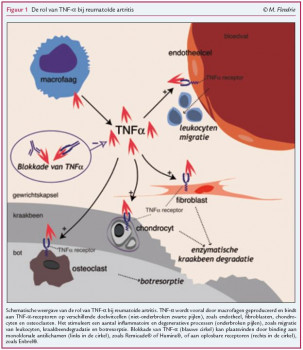
Reumatoïde artritis (RA) is een chronische systemische auto-immuunziekte van onbekende oorzaak, die zich voornamelijk uit in symmetrische gewrichtsontstekingen. De prevalentie is 0,5 tot 1%.1 In de laatste twee decennia is er een grote vooruitgang geboekt in de ontrafeling van de ontstekingsprocessen bij RA. Een belangrijke ontdekking hierbij is de rol van een aantal pro-inflammatoire cytokines, zoals tumornecrosisfactor alfa (TNF-α). Figuur 1 toont schematisch de centrale rol die TNF-α speelt bij de pathogenese van RA. Parallel aan deze ontdekking is een nieuwe groep medicijnen ontwikkeld, met als specifiek doel het antagoneren van deze cytokines, de zogenaamde ‘biologicals’. Uit deze groep zijn de geneesmiddelen die gericht zijn tegen TNF-α als eerste geregistreerd (in 2000) voor de behandeling van RA. Momenteel zijn het de meest toegepaste biologicals in de reumatologische praktijk. Kennis over de effecten en bijwerkingen is van belang voor iedere eerste- en tweedelijnsarts die in zijn dagelijkse praktijk patiënten ziet die een behandeling krijgen met een TNF-α-blokkerend geneesmiddel. Dit artikel geeft een overzicht van belangrijke aspecten van de toepassing van TNF-α-blokkerende geneesmiddelen die in de afgelopen tien jaar uit klinisch onderzoek naar voren zijn gekomen en die relevant zijn voor de dagelijkse praktijk.
TNF-α-blokkerende geneesmiddelen
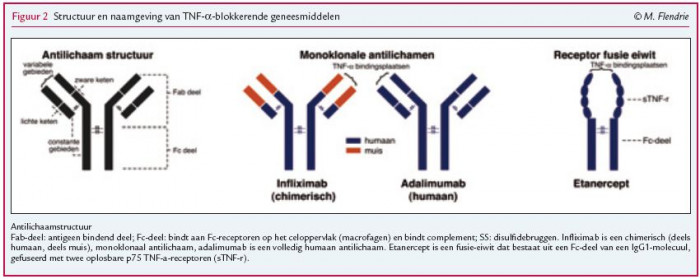
Vlak voor de eeuwwisseling werden twee TNF-α-blokkerende geneesmiddelen, etanercept en infliximab, geregistreerd voor de behandeling van RA in Europa. Verschillende Nederlandse universiteiten en ziekenhuizen hebben een belangrijke bijdrage geleverd aan deze registratie. Zo heeft men in Leiden in het begin van de jaren negentig voor het eerst een RA-patiënt met een TNF-α-blokkerend geneesmiddel behandeld, te weten infliximab. Infliximab (merknaam Remicade®) is een chimerisch, monoklonaal antilichaam, bestaande uit een humaan IgG-1-eiwit, waarvan het bindingsdeel vervangen is door een stukje muizeneiwit met specifieke bindingscapaciteit voor TNF-α (figuur 2). De halfwaardetijd is acht tot tien dagen.1 Etanercept (merknaam Enbrel®) is een fusie-eiwit dat bestaat uit twee oplosbare TNF-α-receptoren, die zijn gebonden aan het Fc-deel van een IgG-1-eiwit (figuur 2). Het heeft een kortere halfwaardetijd van drie tot vier dagen en men dient het toe als subcutane injectie. In 1997 heeft men in het UMC St Radboud in Nijmegen voor het eerst een patiënt behandeld met adalimumab (Humira®). Adalimumab is een volledig humaan monoklonaal antilichaam tegen TNF-α, met een halfwaardetijd van tien tot veertien dagen.1 Inmiddels gebruikt men TNF-α-blokkerende middelen ook voor andere (niet-)reumatische aandoeningen en komen er in de groep van biologicals bijna jaarlijks nieuwe middelen bij. Recentelijk heeft men twee nieuwe TNF-α-blokkerende geneesmiddelen geregistreerd voor de behandeling van RA, te weten golimumab en pegsunercept. Vanwege het beperkte gebruik in de huidige reumatologische praktijk hebben we deze twee nieuwe middelen in dit artikel buiten beschouwing gelaten. Een overzicht van verschillende biologicals voor RA staat in tabel 1.
Naamgeving van TNF-α-blokkerende geneesmiddelen
De generieke naamgeving van biologicals komt voort uit het International Proprietary Names (INN) programma van de World Health Organization (WHO).2 De namen zijn opgedeeld in een aantal stammen (of woorddelen), waarbij het laatste deel de hoofdstam vormt en bepalend is voor het aantal en de aard van de substammen die ervoor staan. Zo eindigen monoklonale antilichamen op de hoofdstam ‘-mab’. De twee substammen ervoor beschrijven in omgekeerde volgorde: 1) de origine van het eiwit (u = humaan, zu = gehumaniseerd, (x)i = chimerisch), en 2) de ziektegroep of het doel (li(m) = immunomodulerend). Het staat de farmaceut vrij om de eerste substam te bepalen, mits het INN-programma deze heeft goedgekeurd. Voor receptormoleculen en interleukinen bestaan andere vervoegingstabellen.2
| Generieke naam (merknaam) | Gericht tegen | Structuur | Jaar van registratie in Europa |
| Infliximab (Remicade®) | TNF-? | Chimerisch* monoklonaal antilichaam | 1999 |
| Etanercept (Enbrel®) | TNF-? | Oplosbaar receptor fusie-eiwit | 2000 |
| Anakinra (Kineret®) | IL-1-receptor | Recombinante receptorantagonist | 2002 |
| Adalimumab (Humira®) | TNF-? | Humaan monoklonaal antilichaam | 2003 |
| Rituximab (Mabthera®) | B-cel | Chimerisch* monoklonaal antilichaam | 2006 |
| Abatacept (Orencia®) | CD80/86 | Humaan fusie-eiwit | 2007 |
| Tocilizumab (RoActemra®) | IL-6-receptor | Gehumaniseerd monoklonaal antilichaam | 2009 |
| Certolizumab pegol (Cimzia®) | TNF-? | Recombinant gehumaniseerd antilichaam fragment | 2009 |
| Golimumab (Simponi®) | TNF-? | Humaan monoklonaal antilichaam | 2009 |
Effectiviteit van TNF-α-blokkerende geneesmiddelen
De effectiviteit van de drie genoemde TNF-α-blokkerende geneesmiddelen is aangetoond in verschillende placebogecontroleerde klinische trials, zowel voor monotherapie als voor de combinatie met het veelgebruikte tweedelijnsgeneesmiddel methotrexaat.1 Later volgden trials van patiënten, vaak met recent ontstane RA met een ziekteduur korter dan twee jaar, waaruit bleek dat de combinatie van TNF-α-blokkerende geneesmiddelen met methotrexaat de ziekteactiviteit beter onderdrukt dan een van beide als monotherapie.4567 Ook bleek dat de gemiddelde gewrichtsschade, zoals vastgesteld via röntgenfoto’s van handen en voeten, duidelijk minder snel progressief was bij patiënten die een behandeling met TNF-α-blokkerende geneesmiddelen kregen. Verschillende onderzoeken hebben de effectiviteit van TNF-α-blokkerende geneesmiddelen in de dagelijkse praktijk aangetoond. Gemiddeld vertoont 60 tot 80% van de RA-patiënten een respons op deze geneesmiddelen, dat wil zeggen een klinisch significante daling van de ziekteactiviteit. Het maximale effect zien we meestal na 12 weken therapie, maar soms kan het tot 6 maanden duren voordat dit effect wordt bereikt. Bij 10 tot 20% is er sprake van remissie, met andere woorden een zeer lage ziekteactiviteit. Na een jaar blijkt dat gemiddeld 10 tot 40% van de RA-patiënten met het medicijn is gestopt vanwege ineffectiviteit of bijwerkingen. Na 2 jaar is dit aantal opgelopen tot 20 tot 50%.1 Hierna treedt er minder uitval op. In het algemeen zijn de drie TNF-α-blokkerende geneesmiddelen adalimumab, infliximab en etanercept gelijkwaardig met betrekking tot effectiviteit, hoewel sommige onderzoeken kleine verschillen laten zien in effectiviteit of medicijntrouw (dat wil zeggen de duur van de periode waarin patiënten hetzelfde geneesmiddel blijven gebruiken).1 Er zijn tot op heden geen aanwijzingen dat een van de nieuwere biologicals beter is dan de drie eerste TNF-α-blokkerende geneesmiddelen.
Het monitoren van de effectiviteit en veiligheid
Aan de hand van klinische trials kan men de effectiviteit of doeltreffendheid in gecontroleerde omstandigheden onderzoeken. De onderzochte RA-populaties betreffen veelal een homogene selectie uit een zeer heterogene groep, waarbij beperkingen gelden met betrekking tot comedicatie en comorbiditeit. Bovendien is de follow-upduur vaak beperkt. Extrapolatie van gegevens met betrekking tot effectiviteit en veiligheid naar de klinische praktijk is daarom niet altijd eenvoudig. Een recent onderzoek heeft laten zien dat eenderde tot de helft van alle RA-patiënten die TNF-α-blokkerende geneesmiddelen kregen niet voldeden aan de inclusiecriteria voor de klinische trials die hebben geleid tot registratie van deze middelen.3 Bovendien bleken patiënten die wel voldeden aan de inclusiecriteria over het algemeen een betere respons op de therapie te hebben. Dit onderzoek laat duidelijk zien dat er sprake is van een beperkte generaliseerbaarheid van gegevens uit klinische trials naar de praktijk en dat het noodzakelijk is om postmarketing onderzoek te doen. Een goede methode om aanvullende gegevens te verkrijgen is longitudinaal observationeel onderzoek. Zo’n onderzoek heeft als voordeel dat het gaat om ‘real-life’ gegevens. Als nadeel geldt dat er niet altijd een goede controlegroep voorhanden is. In verschillende landen in Europa (Engeland, Zweden, Duitsland, Nederland) en in de Verenigde staten heeft men dergelijke onderzoeken op grote schaal uitgevoerd. Het UMC St Radboud is in 2000 begonnen met het monitoren van TNF-α-blokkerende geneesmiddelen en andere biologicals.1 In 2003 heeft dit cohortonderzoek een vervolg gekregen in de vorm van een groter multicenteronderzoek, het DREAM-onderzoek (Dutch Rheumatoid Arthritis Monitoring), waarbij elf ziekenhuizen in voornamelijk het oosten en noorden van Nederland betrokken zijn.3 In dit observationele onderzoek volgt men patiënten met driemaandelijkse visites, waarbij men gegevens verzamelt over onder andere ziekteactiviteit en bijwerkingen.
Antilichaamvorming
Antilichaamvorming tegen TNF-α-blokkerende geneesmiddelen kan optreden bij alle drie geneesmiddelen, zij het met wisselende frequenties. Vooral bij infliximab-gebruik kunnen ten gevolge van het chimere karakter anti-infliximab-antilichamen ontstaan, in sommige onderzoeken tot wel 44% van de patiënten.1 Deze antilichamen kunnen geassocieerd zijn met neutralisatie en een toegenomen klaring van infliximab, waardoor de effectiviteit afneemt. Ook rapporteert men in aanwezigheid van anti-infliximab-antilichamen vaker, maar niet uitsluitend, infusiereacties. Combinatietherapie met methotrexaat is geassocieerd met minder antilichaamvorming en daarom mogelijk met betere effectiviteit en minder infusiereacties. Ook bij adalimumab-gebruik kunnen neutraliserende antilichamen ontstaan die de effectiviteit verminderen, zij het in mindere mate (15%). Of de aanwezigheid van anti-adalimumab-antilichamen leidt tot meer overgevoeligheidsreacties is niet duidelijk. Anti-etanercept-antilichamen zijn zeldzaam en mogelijk niet neutraliserend. Ook zien we tijdens het gebruik van TNF-α-blokkerende geneesmiddelen vaak antinucleaire antilichamen (40% tot 75%). Deze antilichamen zijn echter zeer zelden geassocieerd met het optreden van bijwerkingen, zoals een medicijngeïnduceerde systemische lupus erythematosus.
Bijwerkingen
Uit klinische trials bleek dat TNF-α-blokkerende geneesmiddelen een acceptabel bijwerkingenprofiel hadden. De statistisch meest significante bijwerkingen betroffen huidreacties op de plaats van de injectie en infusiereacties. Gegevens met betrekking tot een verhoogd infectierisico waren aanvankelijk tegenstrijdig, hoewel een meta-analyse later aantoonde dat behandeling met TNF-α-blokkerende geneesmiddelen leidt tot een verhoogd risico op ziekenhuisopname ten gevolge van een infectie.8 Het ging hierbij vooral om pneumonie, urosepsis, tbc-reactivatie en ernstige wekedeleninfecties. Men rapporteerde in 10% van de gevallen tuberculose en opportunistische infecties, wat relatief frequent is. Uit verschillende postmarketingobservaties blijkt dat meer bijwerkingen toegeschreven kunnen worden aan het gebruik van TNF-α-blokkerende geneesmiddelen, onder andere medicijngeïnduceerde systemische lupus erythematosus, demyeliniserende syndromen en verergering van pre-existent hartfalen.9 De belangrijkste zijn weergegeven in tabel 2. Bij de patiënten uit het Nijmeegse cohort kwamen infecties, allergische reacties en huidafwijkingen het meest voor. Ernstige infecties (leidend tot ziekenhuisopname) zag men 4,6 maal per 100 patiëntjaren. Ook hierbij ging het meestal om pneumonie, (uro)sepsis, septische artritis en wekedeleninfecties. Andere observationele onderzoeken meldden vergelijkbare cijfers (5,3 tot 6,4 per 100 patiëntjaren).1 Ook huidafwijkingen zien we frequent tijdens TNF-α-blokkerende behandeling (16 aandoeningen per 100 patiëntjaren).1 Het gaat om een brede variatie van verschillende huidaandoeningen, onder andere huidinfecties, gegeneraliseerde erythemateuze en erythematosquameuze erupties, eczeem, psoriasis en cutane vasculitis. Haaruitval en slijmvliesproblemen rapporteerde men nauwelijks. Aanvankelijk bestond er bezorgdheid over de ontwikkeling van maligniteiten tijdens gebruik van TNF-α-blokkerende geneesmiddelen, in het bijzonder van lymfomen en andere hematologische maligniteiten. Uit een groot observationeel onderzoek uit Zweden blijkt dat lymfomen tweemaal zo vaak voorkomen bij RA-patiënten vergeleken met de normale populatie. RA-patiënten die TNF-α-blokkerende geneesmiddelen gebruikten hadden een risico dat nog iets hoger lag, maar dit effect verdween als men corrigeerde voor factoren die geassocieerd zijn met ziekte-ernst.10
| Bijwerking | Specificatie |
| Ernstige infecties (leidend tot ziekenhuisopname) | Banale infecties (pneumonie, urineweginfectie) kunnen ernstiger en aspecifieker verlopen |
| Tuberculose | Reactivatie van latente tuberculose; vaker extrapulmonale lokalisatie |
| Intracellulaire micro-organismen | Onder andere -species, atypische mycobacteriën |
| Opportunistische micro-organismen | Histoplasmose, Listeriose, Aspergillose, Candidiasis, Cryptococcose |
| Virale infecties | Gordelroos, exacerbatie chronische hepatitis B-infectie |
| Overgevoeligheidsreacties | Infusiereacties (hemodynamische problemen, gegeneraliseerd exantheem), injectieplaatsreacties |
| Medicijngeïnduceerde systemische lupus erythematosus | In het bijzonder huidafwijkingen en anti-ds-DNA; zelden viscerale betrokkenheid |
| Demyeliniserende syndromen | Focale neurologische uitval en wittestoflaesies |
| Vasculitis | In het bijzonder cutane (leukocytoclastische) vasculitis |
| Eczeem | Meestal lokaal, incidenteel gegeneraliseerd |
| Psoriasis en psoriasiforme erupties | Plaque psoriasis en relatief vaak psoriasis pustulosa palmoplantaris |
| Huidinfecties | Meestal mild (schimmel, folliculitis, gordelroos), soms ernstig (necrotiserende fasciitis, uitgebreide gordelroos) |
| Hartfalen | Verergering van pre-existent hartfalen; mogelijk tevens nieuw hartfalen |
| Hematologische afwijkingen | Zeer zeldzaam: pancytopenie, aplastische anemie |
Risicofactoren voor bijwerkingen
Uit het Nijmeegse onderzoek kwam naar voren dat RA-patiënten bij wie men de behandeling van TNF-α-blokkerende geneesmiddelen combineerde met prednison of methotrexaat een significant hoger risico hadden op infecties. De relatieve risico’s die men hierbij vond, waren 2,0 (95%-BI 1,3-3,1), respectievelijk 2,3 (95%-BI 1,3-4,0).1 Het risico op infecties bij gelijktijdig prednisongebruik werd bevestigd in een ander observationeel onderzoek.11 Verder bleken gelijktijdig prednisongebruik en een oudere leeftijd bij start met TNF-α-blokkerende geneesmiddelen risicofactoren voor ernstige bijwerkingen, die leiden tot ziekenhuisopname.1
Screening en preventie van bijwerkingen
De kennis over bijwerkingen heeft geleid tot een aantal duidelijke adviezen voor het gebruik van TNF-α-blokkerende geneesmiddelen in de dagelijkse praktijk. Daarnaast is een aantal aanbevelingen opgesteld waarover in de nabije toekomst mogelijk consensus volgt. Voor een patiënt met TNF-α-blokkerende geneesmiddelen begint, moet hij gescreend worden op de aanwezigheid van een latente of doorgemaakte tuberculose. Patiënten met een latente of inactieve tuberculose kunnen wel een behandeling krijgen met TNF-α-blokkerende geneesmiddelen, maar moeten ook worden behandeld met tbc-profylaxe. Tevens moet men voordat de patiënt met een TNF-α-blokkerend geneesmiddel begint actieve infecties uitsluiten. Indien er tijdens de behandeling een infectie met hoge koorts of ernstige symptomen optreedt, moet men de behandeling kortdurend stoppen. Als een arts twijfelt of de patiënt moet stoppen, is het aan te raden om advies in te winnen bij de behandelend reumatoloog. Hierbij moeten we erop wijzen dat ook een kortdurende onderbreking van enkele weken in een opvlamming van de RA kan resulteren. Hartfalen (NYHA-klasse III of IV) geldt als een absolute contra-indicatie voor gebruik van TNF-α-blokkerende geneesmiddelen. In samenspraak met de patiënt wijken artsen hier echter soms van af als ze het gevoel hebben met de rug tegen de muur te staan. Relatieve contra-indicaties voor gebruik van TNF-α-blokkerende geneesmiddelen zijn onder andere chronische infecties (chronische hepatitis B), demyeliniserende ziekten, maligniteiten (actueel of gedurende de laatste vijf jaar), leverfalen, zwangerschap en borstvoeding. Men adviseert actief op chronische hepatitis B en C te screenen, maar dat gebeurt nog niet overal.12 Ook gelden momenteel de volgende vaccinatieadviezen. Patiënten moeten jaarlijks een griepinenting krijgen. Passieve vaccinaties of vaccinaties met een geïnactiveerd (dood) virus zijn toegestaan, maar kunnen tot een lagere antilichaamtiter leiden dan bij de gezonde populatie.12 Vaccinaties met een levend verzwakt vaccin, zoals het gelekoortsvaccin, zijn absoluut gecontraïndiceerd en moeten plaatsvinden voor de start met TNF-α-blokkerende geneesmiddelen of na een adequate wash-out-periode. Reizigers die naar landen gaan waarvoor een vaccinatieadvies geldt, moet men adviseren naar de GGD of een travelclinic te gaan. Over het gebruik van TNF-α-blokkerende geneesmiddelen bij vrouwen die zwanger zijn, zwanger willen worden of borstvoeding geven, bestaan momenteel nog onvoldoende gegevens. Een aantal kleinere onderzoeken laat geen verhoogde incidentie zien van abortus of miskramen na gebruik van TNF-α-blokkerende geneesmiddelen, maar grotere onderzoeken ontbreken.12 Vanwege de langere halfwaardetijd van infliximab en adalimumab is het aan te bevelen ten minste vijf, respectievelijk zes, maanden na het stoppen met de medicatie door te gaan met anticonceptiva.
Huidige indicaties en kosten
TNF-α-blokkerende geneesmiddelen zijn effectief gebleken bij de behandeling van verschillende auto-immuunziekten. Het indicatiegebied breidt zich dan ook langzaam uit, zowel met betrekking tot de geregistreerde als de niet-geregistreerde (off-label) indicaties (tabel 3). Bij dit laatste gaat het om indicaties waarvoor de fabrikant geen registratie heeft aangevraagd, maar waarbij het College van Zorgverzekeringen op grond van adviezen door de Commissie Farmaceutische Hulp (CFH) wel de werkzaamheid voor de betreffende indicatie erkent en waarbij aan bepaalde voorwaarden is voldaan. Voorwaarden voor vergoeding bestaan onder andere uit eisen met betrekking tot de uitgebreidheid van ziekte en eerder therapiefalen. Ook moet een specialist het recept hebben ondertekend. De kosten voor de standaardbehandeling in Nederland (zonder dosis- of intervalaanpassingen) bedragen jaarlijks rond de € 11.000,- voor infliximab en € 14.000,- voor etanercept en adalimumab.4
| Geregistreerde indicaties* | Welk TNF-?-blokkerend middel? |
| Reumatoïde artritis | Infliximab, etanercept, adalimumab |
| Artritis psoriatica | Infliximab, etanercept, adalimumab |
| Spondylitis ankylopoëtica (ziekte van Bechterew) | Infliximab, etanercept, adalimumab |
| Ziekte van Crohn | Infliximab, adalimumab |
| Colitis ulcerosa | Infliximab |
| Plaque psoriasis | Infliximab, etanercept, adalimumab |
| Juveniele idiopathische artritis | Etanercept, adalimumab |
| Ongeregistreerde indicaties* | |
| Ziekte van Crohn | Etanercept |
| Uveïtis | Infliximab, adalimumab |
| Hydradenitis suppurativa | Infliximab, etanercept, adalimumab |
| Sarcoïdose | Infliximab, etanercept, adalimumab |
| Polymyositis | Etanercept |
| Ziekte van Wegener | Etanercept |
| Ziekte van Takayasu | Etanercept |
Conclusie
De komst van TNF-α-blokkerende geneesmiddelen heeft de behandeling van RA ingrijpend veranderd. Waar voorheen bij veel patiënten controle van ziekteactiviteit het hoofddoel was, vindt nu een verschuiving plaats naar het bereiken van een snelle en volledige remissie. Het percentage patiënten dat dit doel ook daadwerkelijk haalt door gebruik van TNF-α-blokkerende geneesmiddelen is nog laag. De specifieke remming van TNF-α kan ook leiden tot ongewenste effecten op het afweersysteem, zoals een verhoogde infectiegevoeligheid en verschillende auto-immuunfenomenen. Deze effecten en andere bijwerkingen van TNF-α-blokkerende geneesmiddelen vragen om een verhoogde waakzaamheid en intensieve monitoring tijdens het gebruik. Voor zowel patiënten als artsen die in hun praktijk te maken krijgen met het gebruik van TNF-α-blokkerende geneesmiddelen is het van belang op de hoogte te zijn van het verhoogde infectierisico en een mogelijk ernstiger verloop van infecties. Hoewel reumatologen laagdrempelig bereikbaar zijn voor patiënten wanneer het gaat om infecties en andere mogelijke bijwerkingen, kunnen ook huisartsen geconfronteerd worden met deze problematiek. Kennis over TNF-α-blokkerende geneesmiddelen en een nauwe samenwerking tussen eerste en tweede lijn is belangrijk om tijdig de risico’s te onderkennen en adequaat te handelen in geval van mogelijke bijwerkingen.
Literatuur
- 1.↲↲↲↲↲↲↲↲↲↲↲↲Flendrie M. Effectiveness and safety of TNF-alpha blocking therapy in patients with rheumatoid arthritis [Proefschrift]. Wageningen: Ponsen & Looijen, 2009. Digitaal beschikbaar via dare.ubn.kun.nl.
- 2.↲↲World Health Organisation International Proprietary Names (INN) program, www.who.int/medicines/services/inn/en.
- 3.↲↲Kievit W, Fransen J, Oerlemans AJ, Kuper HH, Van der Laar MA, De Rooij DJ, et al. The efficacy of anti-TNF in rheumatoid arthritis, a comparison between randomised controlled trials and clinical practice. Ann Rheum Dis 2007;66:1473-8.
- 4.↲↲Van den Bemt BJF, Den Broeder AA, Van der Tempel H, Van den Hoogen FHJ, Breedveld FC, Janknegt R. InforMatrix behandeling reumatoïde artritis met biologicals. Ned Tijdschr Reumatol 2008;1:1-51.
- 5.↲Breedveld FC, Weisman MH, Kavanaugh AF, Cohen SB, Pavelka K, Van Vollenhoven R, et al. The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006;54:26-37.
- 6.↲Klareskog L, Van der Heijde D, De Jager JP, Gough A, Kalden J, Malaise M, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004;363:675-81.
- 7.↲Maini RN, Breedveld FC, Kalden JR, Smolen JS, Davis D, Macfarlane JD, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor alpha monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998;41:1552-63.
- 8.↲Bongartz T, Sutton AJ, Sweeting MJ, Buchan I, Matteson EL, Montori V. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006;295:2275-85.
- 9.↲Hyrich KL, Silman AJ, Watson KD, Symmons DP. Anti-tumour necrosis factor {alpha} therapy in rheumatoid arthritis: an update on safety. Ann Rheum Dis 2004;63:1538-43.
- 10.↲Askling J, Fored CM, Baecklund E, Brandt L, Backlin C, Ekbom A, et al. Haematopoietic malignancies in rheumatoid arthritis: lymphoma risk and characteristics after exposure to tumour necrosis factor antagonists. Ann Rheum Dis 2005;64:1414-20.
- 11.↲Schneeweiss S, Setoguchi S, Weinblatt ME, Katz JN, Avorn J, Sax PE, et al. Anti-tumor necrosis factor alpha therapy and the risk of serious bacterial infections in elderly patients with rheumatoid arthritis. Arthritis Rheum 2007;56:1754-64.
- 12.↲↲↲Furst DE, Keystone EC, Fleischmann R, Mease P, Breedveld FC, Smolen JS, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2009. Ann Rheum Dis 2010;69:i2-i29.
Reacties
Er zijn nog geen reacties.