Samenvatting
Inleiding Om de vroege herkenning van artritis te bevorderen kunnen huisartsen in Leiden en omstreken bij twijfel over de aanwezigheid van artritis verwijzen naar een anderhalvelijnsinlooppoli voor gewrichtsonderzoek door een reumatoloog. In andere regio’s is deze laagdrempelige service niet beschikbaar. Om deze regio’s een handvat te bieden onderzochten we op basis van gegevens van de inlooppoli of een eenvoudige scorelijst behulpzaam kan zijn bij het herkennen van artritis.
Methode Patiënten die van september 2010 tot en met september 2015 werden verwezen vanwege twijfel over de aanwezigheid van artritis (n = 1288) vulden een vragenlijst in over hun symptomen. Voor het ontwikkelen en valideren van de scorelijst verdeelden we ze in twee groepen. Vragenlijstonderdelen die samenhingen met de aanwezigheid van artritis bij het gewrichtsonderzoek door de reumatoloog namen we op in een gewogen scorelijst. Deze geeft de kans op artritis weer.
Resultaten We stelden artritis vast bij 41% van de patiënten. De scorelijst bevat slechts zeven factoren: mannelijk geslacht, leeftijd ≥ 60, symptoomduur < 6 weken, ochtendstijfheid > 60 minuten, 1-3 pijnlijke gewrichten, door de patiënt gerapporteerde gewrichtszwelling en moeite met het maken van een vuist. Het gebied onder de ROC-curve was in het ontwikkelingscohort en validatiecohort respectievelijk 0,74 (95%-BI 0,70 tot 0,78) en 0,71 (95%-BI 0,67 tot 0,75).
Conclusie Bij twijfel over de aanwezigheid van artritis kan een eenvoudige scorelijst huisartsen helpen bepalen of zij de patiënt moeten verwijzen. Validatie van de lijst in de eerste lijn is echter nodig.
Wat is bekend?
-
Bij reumatoïde artritis hangt vroeg starten met medicamenteuze behandeling sterk samen met betere uitkomsten.
-
De herkenning van vroege artritis door huisartsen is belangrijk voor tijdige doorverwijzing.
-
Huisartsen vinden het echter vaak lastig om zwelling vast te stellen door gewrichtspalpatie. De incidentie van artritis is relatief laag, terwijl de incidentie van andere musculoskeletale diagnoses vele malen hoger is.
Wat is nieuw?
-
Met patiënten die werden verwezen met een vermoeden van artritis ontwikkelden we een scorelijst om vroegtijdige herkenning van artritis door huisartsen te ondersteunen.
-
Deze scorelijst bestaat uit zeven eenvoudige vragen en geeft een schatting van het risico op artritis bij patiënten bij wie er twijfel is over de aanwezigheid van artritis.
Inleiding
Bij reumatoïde artritis (RA) is het belangrijk om vroeg met medicatie te starten, omdat dat sterk samenhangt met betere uitkomsten.1 Ook voor andere inflammatoire artritiden, zoals artritis psoriatica of undifferentiated arthritis, lijkt dit te gelden.23 Daarom adviseert de NHG-Standaard Artritis huisartsen om patiënten met een vermoeden van artritis (in brede zin) drie weken na het ontstaan van de klachten te verwijzen, waarbij de reumatoloog de patiënt binnen zes weken zou moeten zien.4 Het voelen van gewrichtszwelling bij palpatie (gewrichtsonderzoek) is de aangewezen methode om artritis vast te stellen. Hoewel een onderzoek liet zien dat huisartsen het nut van tijdige verwijzing onderschrijven, blijken ze het detecteren van vroege RA lastig te vinden, wellicht door de lage prevalentie van artritis in de huisartsenpraktijk.5 Musculoskeletale klachten komen veel voor in de eerste lijn, maar de incidentie van artritis is relatief laag (0,7/1000 patiëntjaren).67 Daar komt bij dat ontstekingsverschijnselen van kleine gewrichten juist in de vroegste fase subtiel kunnen zijn en bij lichamelijk onderzoek dus lastig te ontdekken zijn.
Geraadpleegde huisartsen gaven aan bij twijfel over artritis vaak enige tijd af te wachten. Onderzoek uit 2010 in de Leidse regio liet zien dat de tijd tussen het eerste huisartsbezoek en het bezoek aan de reumatoloog gemiddeld acht weken was en de grootste component vormde in de algehele diagnostische ‘vertraging’ van veertien weken. Daarbij bedroeg de wachttijd voor de polikliniek reumatologie bij een vermoeden van artritis maximaal een tot twee weken.8 Om vroege herkenning te bevorderen is daarom in september 2010 de Early Arthritis Recognition Clinic (EARC) opgestart op de polikliniek reumatologie van het Leids Universitair Medisch Centrum, ter aanvulling op lichamelijk onderzoek door de huisarts. Deze inlooppoli is bestemd voor patiënten bij wie de huisarts twijfelt of er sprake is van artritis en is na verwijzing wekelijks toegankelijk. De reumatoloog op de inlooppoli verricht alleen gewrichtsonderzoek. In geval van artritis komen de patiënten terug voor een verdere analyse. Als er geen artritis is, gaan de patiënten zonder aanvullend onderzoek terug naar de huisarts. Deze vorm van anderhalvelijnszorg heeft de vroege herkenning van artritis aantoonbaar verbeterd.9
Omdat een dergelijke vorm van zorg in de meeste regio’s ontbreekt onderzochten wij of we een hulpmiddel konden ontwikkelen dat huisartsen kan helpen wanneer ze twijfelen over de aanwezigheid van artritis. Daarvoor maakten we gebruik van gegevens die we via de inlooppoli verkregen hebben.
Methode
Het oorspronkelijke artikel bevat een gedetailleerde beschrijving van de gebruikte methode.10
Patiënten en gegevens
Alle patiënten die de inlooppoli tussen september 2010 en september 2015 bezochten namen we op in ons onderzoek. Voordat een reumatoloog op de inlooppoli gewrichtsonderzoek deed en de aanwezigheid van artritis onderzocht vulden de patiënten een korte vragenlijst in. Naast leeftijd en geslacht waren de onderdelen van de vragenlijst gebaseerd op kenmerken die normaliter aan bod komen bij de anamnese: de begindatum van de klachten, de datum van het eerste bijbehorende bezoek aan de huisarts, een plotseling of geleidelijk begin van de klachten, ochtendstijfheid in minuten, tijdens welk dagdeel de klachten het ergst waren, of er moeite was bij het maken van een vuist en welke gewrichten de patiënt als pijnlijk of gezwollen ervoer.411 Conform de NHG-Standaard Artritis raadden we de deelnemende huisartsen af om voorafgaand aan het bezoek antistofbepalingen te doen.4 Ook tijdens het bezoek aan de inlooppoli vond geen aanvullend onderzoek plaats. De uitkomst, artritis, werd door middel van gewrichtsonderzoek bepaald. Alle artritiden werden hierbij meegenomen, ongeacht de (vermeende) oorzaak.
Afleiding en validatie van de scorelijst
We gebruikten de helft van de gegevens (de oneven bezoeknummers) voor het afleiden van de scorelijst (het ontwikkelingscohort) en de andere helft (de even bezoeknummers) voor het valideren (het validatiecohort). Eerst bepaalden we verbanden tussen de vragenlijstonderdelen en artritis bij het lichamelijk onderzoek door middel van univariabele logistische regressie. Daarna toetsten we gerelateerde variabelen in een multivariabel logistisch regressiemodel. Met het oog op de praktische toepasbaarheid categoriseerden we continue variabelen (leeftijd, symptoomduur, duur van de ochtendstijfheid, het aantal pijnlijke en gezwollen gewrichten) met klinisch relevante afkapwaarden en voegden we categorieën met vergelijkbare regressiecoëfficiënten samen, waardoor bredere en eenvoudiger toepasbare categorieën ontstonden. De categorieën baseerden we op de classificatiecriteria voor RA en de geobserveerde verdeling van de gegevens in het ontwikkelingscohort.12 De scorelijst leidden we af uit het multivariabele model door de regressiecoëfficiënten af te ronden op halve waarden (ongeacht de statistische significantie), resulterend in een makkelijk te berekenen score. Per score berekenden we de kans op de aanwezigheid van artritis. Als maat voor het discriminerend vermogen berekenden we de area under the receiver operating characteristic curve (AUC).
Aangezien de achterafkans (na toepassing van de scorelijst) op artritis sterk afhankelijk is van de voorafkans, die in huisartsenpraktijken lager zal zijn dan op het inloopspreekuur, voerden we een simulatie uit voor een artritisprevalentie van 20%. De schatting van 20% bepaalden we op basis van eerder onderzoek uit Nederlandse huisartsenpraktijken met de dossiers van patiënten met de diagnose aspecifieke artritis (regio Nijmegen, 1990-2004, n = 362) of met de ICPC-1-code L88 voor artritis (regio Leiden, 2009-2013, n = 126).1314 Hieruit leidden we af dat een vermoeden van artritis door de huisarts naar schatting terecht is bij 18 tot 27%. Precieze en zekere getallen hierover ontbreken.
Resultaten
Patiëntkenmerken
In totaal bezochten 1288 patiënten de inlooppoli. Uit gewrichtsonderzoek bleek dat 41% van hen artritis had. In [tabel 1] staan de patiëntkenmerken.
Afleiden en valideren van de scorelijst
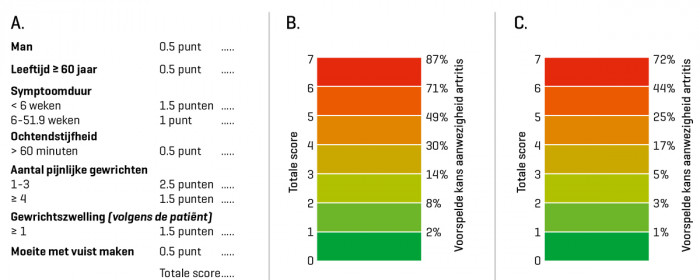
De volgende variabelen hingen in het multivariabele model samen met de aanwezigheid van artritis [tabel 2]: mannelijk geslacht, leeftijd ≥ 60 jaar, symptoomduur, ochtendstijfheid > 60 minuten, een beperkt aantal pijnlijke gewrichten (1-3), door de patiënt gerapporteerde gewrichtszwelling en moeite met het maken van een vuist. Ochtendstijfheid > 60 minuten namen we met een regressiecoëfficiënt van 0,49 wel in de scorelijst op, ook al bereikte deze variabele geen statistische significantie. Na afronding van de regressiecoëfficiënten namen we deze zeven variabelen op in de uiteindelijke scorelijst, met een scorebereik van 0 tot 7,5 punt [figuur 1A]. Zoals uitgedrukt in [figuur 1B] is de kans dat artritis aanwezig is groter bij een hoger puntenaantal.
Het algehele discriminerende vermogen, uitgedrukt in AUC (95%-BI), was 0,74 (0,70 tot 0,78). In het validatiecohort vonden we vergelijkbare risicoschattingen en een AUC van 0,71 (0,67 tot 0,75).
In een simulatie schatten we de kansen op aanwezigheid van artritis bij een prevalentie van 20% in plaats van de geobserveerde 41%. De bijbehorende kansen op aanwezigheid van artritis staan in [figuur 1C].
Figuur 1 | De CARE (Clinical Arthritis RulE)-tool (A) met voorspelde kansen op de aanwezigheid van artritis (B en C). Met de berekende score kan de kans op de aanwezigheid van artritis worden afgelezen, uitgaande van een voorafkans van 41%, zoals geobserveerd in onze gegevens (B) en bij een voorafkans van 20%, geschat op basis van gegevens uit huisartsenpraktijken (C).
Beschouwing
Omdat vroege herkenning van artritis in de eerste lijn moeilijk is, hebben we een eenvoudige scorelijst ontwikkeld. Deze lijst hebben we gevalideerd in de anderhalvelijnssetting van de inlooppoli en is bruikbaar voor de vroege herkenning van artritis. De scorelijst, genaamd CARE-tool [figuur 1A], kan online ingevuld worden om de kans op de aanwezigheid van artritis te berekenen. Alle onderdelen (behalve de aanwezigheid van door de patiënt gerapporteerde gewrichtszwelling) staan in de NHG-Standaard Artritis. Vernieuwend is de weging die aan deze factoren wordt toegekend voor het inschatten van het risico op artritis.
De belangrijkste beperking van ons onderzoek is dat we de scorelijst nog niet hebben gevalideerd in de eerste lijn. Een simulatie was gebaseerd op de schatting dat de huisarts in een op de vijf gevallen (een prevalentie van 20%) de aanwezigheid van artritis juist inschatte. De gegevens die hieraan ten grondslag lagen waren echter mager: de schatting kan te hoog, maar ook te laag zijn. De volgende stap zou daarom validatie in de eerstelijnszorg zijn. Een verschil met de dagelijkse praktijk is dat de huisarts de benodigde gegevens voor het invullen van de CARE-tool meestal via de anamnese zal verkrijgen en niet via een door de patiënt zelf ingevulde vragenlijst, zoals bij dit onderzoek.
Een andere beperking is dat we niet weten hoeveel patiënten wel een verwijzing hadden gekregen maar niet naar de inlooppoli zijn gegaan (ondanks de goede toegankelijkheid). Dit kan de gevonden prevalentie hebben beïnvloed. Toch suggereert de geobserveerde prevalentie van 41% dat huisartsen goed trieerden, aangezien bij bijna een op de twee verwezen patiënten de twijfel aan artritis terecht bleek te zijn. Dit is aanzienlijk, omdat musculoskeletale klachten een van de meest voorkomende aanleidingen zijn voor een bezoek aan de huisarts.67
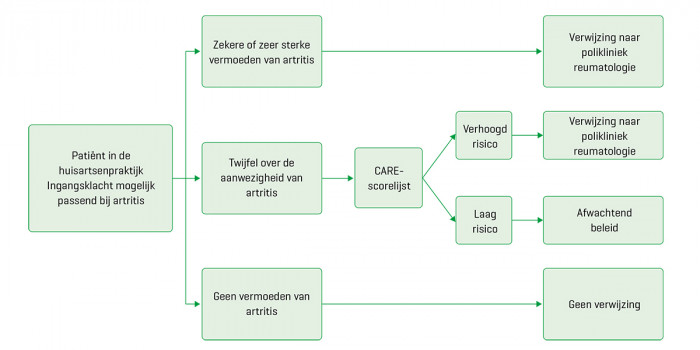
Belangrijk is dat de scorelijst is ontwikkeld met een groep patiënten bij wie de huisarts een vermoeden van artritis had. De scorelijst is daardoor ongeschikt voor toepassing op de gehele eerstelijnspatiëntenpopulatie met musculoskeletale klachten. In dat geval is de prevalentie van artritis namelijk zeer laag, waardoor de test een heel lage positief voorspellende waarde zal hebben. Huisartsen kunnen de CARE-tool daarom het beste gebruiken als ze daadwerkelijk twijfelen aan de aanwezigheid van artritis (met geschatte voorafkansen van 41 en 20%), wat het stroomschema in [figuur 2] illustreert.
Figuur 2 | Stroomdiagram met een voorstel voor de besluitvorming bij patiënten die vermoedelijk artritis hebben en de mogelijke rol van de CARE-tool
Wat te doen in geval van een hoge kans op de aanwezigheid van artritis is afhankelijk van zowel de patiënt als de lokale situatie. In Nederland adviseert de NHG-Standaard Artritis verwijzing in plaats van aanvullend onderzoek, zoals het bepalen van antistoffen, omdat ongeveer de helft van de RA-patiënten antistofnegatief is en vroege herkenning ook in deze groep belangrijk is.
Welke afkapwaarde voor de CARE-tool moet worden gebruikt hangt af van de zekerheid die gewenst is voor de verwijzing. Op basis van gegevens uit het ontwikkelingscohort geldt het volgende: een hoge sensitiviteit (> 90%) wordt bereikt met een afkapwaarde van ≥ 4, een hoge specificiteit (> 90%) met een afkapwaarde van ≥ 6. Verder is van belang dat een AUC van 0,71-0,74 redelijk is, maar dat deze tool een benadering blijft en het gewrichtsonderzoek van de reumatoloog (de gouden standaard) niet kan vervangen.
Tot slot bevat de scorelijst enkele factoren die niet typisch zijn voor RA (mannelijk geslacht, beperkt aantal pijnlijke gewrichten). Dit hangt mogelijk samen met het feit dat er bij de patiënten die uiteindelijk geen artritis bleken te hebben relatief vaak sprake was van andere verklaringen, zoals artrose of reumatologisch onvoldoende verklaarde pijnklachten. Dit was vooral het geval bij vrouwen en patiënten met een relatief groot aantal pijnlijke gewrichten.
Conclusie
Huisartsen spelen een cruciale rol bij de vroege herkenning van artritis. Wij ontwikkelden een tool die van nut kan zijn bij de besluitvorming bij twijfel over de aanwezigheid van artritis. Verdere validatie in de eerste lijn is nodig.
| Ontwikkelingscohort (n = 644) | Validatiecohort (n = 644) | |
|---|---|---|
| Man, n (%) | 190 (30) | 198 (31) |
| Leeftijd in jaren, gemiddelde (± sd) | 52 (± 16) | 51 (± 17) |
| Symptoomduur in weken, mediaan (IKA) | 10 (3–45) | 12 (4–45) |
| Plotseling begin van de klachten, n (%) | 252 (39) | 238 (37) |
| Ergste symptomen in de vroege ochtend, n (%) | 372 (58) | 351 (55) |
| Ochtendstijfheid in minuten, mediaan (IKA) | 10 (0–30) | 10 (0–30) |
| Aantal pijnlijke gewrichten, mediaan (IKA) | 7 (2–15) | 6 (3–15) |
| Aantal gezwollen gewrichten volgens de patiënt, mediaan (IKA) | 2 (1–5) | 2 (1–5) |
| Moeite met het maken van een vuist, n (%) | 329 (51) | 301 (47) |
| Artritis bij gewrichtsonderzoek door ervaren reumatoloog, n (%) | 271 (42) | 252 (39) |
| Ontwikkelingscohort | Validatiecohort | |||
|---|---|---|---|---|
| OR (95%-BI) | ß | OR (95%-BI) | ||
| Man | 1,7 (1,1 – 2,5) | 0,52 | 1,7 (1,1 – 2,4) | |
| Leeftijd in jaren | < 60 | (ref) | (ref) | |
| ≥ 60 | 2,1 (1,4 – 3,1) | 0,75 | 2,1 (1,5 – 3,0) | |
| Symptoomduur in weken | ≥ 52 | (ref) | 1,28 | (ref) |
| 6–51 | 2,2 (1,4 – 3,6) | 0,80 | 1,9 (1,2 – 3,0) | |
| < 6 | 3,6 (2,2 – 6,0) | 3,4 (2,0 – 5,7) | ||
| Plotseling begin van de klachten | 1,0 (0,7 – 1,5) | –0,02 | 1,0 (0,7 – 1,5) | |
| Ochtendstijfheid > 60 minuten | 1,6 (0,9 – 2,9) | 0,49 | 1,2 (0,6 – 2,3) | |
| Aantal pijnlijke gewrichten | 0 | (ref) | (ref) | |
| 1–3 | 10,0 (1,2 – 83,4) | 2,30 | 7,9 (0,9 – 68,6) | |
| ≥ 4 | 4,5 (0,5 – 37,1) | 1,50 | 5,2 (0,6 – 45,1) | |
| Aantal gezwollen gewrichten volgens de patiënt | 0 | (ref) | (ref) | |
| ≥ 1 | 3,5 (1,9 – 6,6) | 1,25 | 3,7 (1,9 – 7,0) | |
| Moeite met het maken van een vuist | 1,6 (1,0 – 2,6) | 0,47 | 1,4 (0,9 – 2,2) | |
| Constante | –4,60 |
Literatuur
- 1.↲Van Nies JA, Krabben A, Schoones JW, Huizinga TW, Kloppenburg M, Van der Helm-Van Mil AH. What is the evidence for the presence of a therapeutic window of opportunity in rheumatoid arthritis? A systematic literature review. Ann Rheum Dis 2014;73:861-70.
- 2.↲Lopez-Olivo MA, Kakpovbia-Eshareturi V, Des Bordes JK, Barbo A, Christensen R, Suarez-Almazor ME. Treating early undifferentiated arthritis: a systematic review and meta-analysis of direct and indirect trial evidence. Arthritis Care Res 2018;70:1355-65.
- 3.↲McLaughlin M, Ostör A. Early treatment of psoriatic arthritis improves prognosis. Practitioner 2014;258:21-4, 3.
- 4.↲↲↲NHG-werkgroep Artritis. NHG-Standaard Artritis (eerste herziening). Utrecht: Nederlands Huisartsen Genootschap, 2017.
- 5.↲Meyfroidt S, Stevens J, De Lepeleire J, Westhovens R, De Cock D, Van der Elst K, et al. A general practice perspective on early rheumatoid arthritis management: a qualitative study from Flanders. Eur J Gen Pract 2015;21:231-7.
- 6.↲↲NIVEL. Zorgregistraties eerste lijn. Incidenties en prevalenties. Utrecht: NIVEL, 2017.
- 7.↲↲NIVEL. Nederlanders vooral met beweegklachten naar de huisartsen. Utrecht: NIVEL, 2018.
- 8.↲Van der Linden MPM, Le Cessie S, Raza K, Van der Woude D, Knevel R, Huizinga TWJ, et al. Long-term impact of delay in assessment of patients with early arthritis. Arthritis Rheum 2010;62:3537-46.
- 9.↲Van Nies JA, Brouwer E, Van Gaalen FA, Allaart CF, Huizinga TW, Posthumus MD, et al. Improved early identification of arthritis: evaluating the efficacy of Early Arthritis Recognition Clinics. Ann Rheum Dis 2013;72:1295-301.
- 10.↲Ten Brinck RM, Van Dijk BT, Van Steenbergen HW, Le Cessie S, Numans ME, Hider SL, et al. Development and validation of a clinical rule for recognition of early inflammatory arthritis. BMJ Open 2019;8:e023552.
- 11.↲Manson JJ, Wing C. The rheumatological history. Medicine 2018;46:156-60.
- 12.↲Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, 3rd, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010;62:2569-81.
- 13.↲Newsum EC, De Waal MWM, Van Steenbergen HW, Gussekloo J, Van der Helm-van Mil AHM. How do general practitioners identify inflammatory arthritis? A cohort analysis of Dutch general practitioner electronic medical records. Rheumatology 2016;55:848-53.
- 14.↲Knuiman CA, Schers HJ. Het beloop van aspecifieke artritis. Huisarts Wet 2011;54:234-6.
Reacties
Er zijn nog geen reacties.