Samenvatting
Abstract
De kern
-
Vroegtijdige opsporing en behandeling van hiv heeft grote voordelen voor de patiënt en voor de volksgezondheid.
-
Vooralsnog heeft het aanbieden van hiv-tests aan patiënten uit risicogroepen onvoldoende geleid tot een kentering in de hiv-epidemie in Nederland. Andere teststrategieën zijn nodig.
-
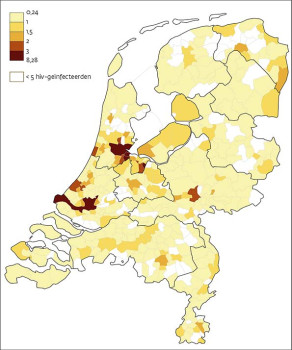
Twee veelbelovende teststrategieën zijn het aanbieden van hiv-tests aan patiënten met hiv-gerelateerde aandoeningen en een proactief beleid van routinematig testen in gebieden waar de hiv-prevalentie hoger is dan 2 per 1000 inwoners.
Het einde van hiv en aids
Testen bij risicogroepen
Testen bij indicatoraandoeningen
|
|
|
|
|
|
De hiv-prevalentie in kaart gebracht
Bevorderende en belemmerende factoren bij nieuwe teststrategieën
Conclusie
Dankwoord
Literatuur
- 1.↲90-90-90: An ambitious treatment target to help end the AIDS epidemic. Geneva: UNAIDS; 2014.
- 2.↲↲↲↲Van Sighem AI, Gras LA, Smit C, et al. Monitoring report 2015. Amsterdam: Stichting HIV Monitoring, 2015.
- 3.↲Op de Coul EL, Van Sighem A, Brinkman K, Benthem BH, Ende ME, Geerlings S, et al. Factors associated with presenting late or with advanced HIV disease in the Netherlands, 1996-2014: results from a national observational cohort. BMJ Open 2016;6:e009688.
- 4.↲Lundgren JD, Babiker AG, Gordin F, Emery S, Grund B, Sharma S, et al. Initiation of antiretroviral therapy in early asymptomatic HIV Infection. N Engl J Med 2015;373:795-807.
- 5.↲Danel C, Moh R, Gabillard D, Badje A, Le Carrou J, Ouassa T, et al. A trial of early antiretrovirals and isoniazid preventive therapy in Africa. N Engl J Med 2015;373:808-22.
- 6.↲Bezemer D, De Wolf F, Boerlijst MC, Van Sighem A, Hollingsworth TD, Fraser C. 27 years of the HIV epidemic amongst men having sex with men in the Netherlands: an in depth mathematical model-based analysis. Epidemics 2010;2:66-79.
- 7.↲Van Sighem A, Vidondo B, Glass TR, Bucher HC, Vernazza P, Gebhardt M, et al. Resurgence of HIV infection among men who have sex with men in Switzerland: mathematical modelling study. PloS one 2012;7:e44819.
- 8.↲Cohen MS, Chen YQ, McCauley M, Gamble T, Hosseinipour MC, Kumarasamy N, et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med 2011;365:493-505.
- 9.↲↲↲Van Bergen JEAM, Dekker JH, Boeke AJP, Kronenberg EHA, Van der Spruit R, Burgers JS, et al. NHG-Standaard Het soa-consult (eerste herziening). Huisarts Wet 2013;56:450-63.
- 10.↲↲Vos J, Pype P, Deblonde J, Van den Eynde S, Aelbrecht K, Deveugele M, et al. Collecting and registering sexual health information in the context of HIV risk in the electronic medical record of general practitioners: a qualitative exploration of the preference of general practitioners in urban communities in Flanders (Belgium). Prim Health Care Res Dev 2016;17:333-50.
- 11.↲↲Callander D, Bourne C, Pell C, Finlayson R, Forssman B, Baker D, et al. Recording the sexual orientation of male patients attending general practice. Fam Pract 2015;32:35-40.
- 12.↲Manirankunda L, Loos J, Debackaere P, Nostlinger C. ‘It is not easy’: challenges for provider-initiated HIV testing and counseling in Flanders, Belgium. AIDS Educ Prev 2012;24:456-68.
- 13.↲Kroon FP. De behandeling van hiv anno 2017. Huisarts Wet 2017;60(1):42-6.
- 14.↲↲↲HIV indicator conditions: Guidance for implementing HIV testing in adults in healthcare settings. Copenhagen: HIV In Europe, 2012. http://hiveurope.eu, geraadpleegd juli 2016.
- 15.Raben D, Mocroft A, Rayment M, Mitsura vm, Hadziosmanovic V, Sthoeger ZM, et al. Auditing HIV Testing Rates across Europe: Results from the HIDES 2 Study. PLoS One 2015;10:e0140845.
- 16.↲Joore IK, Arts DL, Kruijer MJ, Moll van Charante EP, Geerlings SE, et al. HIV indicator condition-guided testing to reduce the number of undiagnosed patients and prevent late presentation in a high-prevalence area: a case–control study in primary care. Sex Transm Infect 2015;91:467-72.
- 17.↲Agusti C, Montoliu A, Mascort J, Carrillo R, Almeda J, Elorza JM, et al. Missed opportunities for HIV testing of patients diagnosed with an indicator condition in primary care in Catalonia, Spain. Sex Transm Infect 2016;92:387-92.
- 18.↲On the fast-track to end AIDS by 2030: Focus on location and population. World Aids Day Report 2015. Geneva: UNAIDS; 2015.
- 19.↲Jones A, Cremin I, Abdullah F, Idoko J, Cherutich P, Kilonzo N, et al. Transformation of HIV from pandemic to low-endemic levels: a public health approach to combination prevention. Lancet 2014;384:272-9.
- 20.↲National Institute for Health and Care Excellence. HIV testing: increasing uptake in black Africans. Public Health Guidance 33, London: NICE, 2011.
- 21.↲National Institute for Health and Care Excellence. HIV testing: increasing uptake in men who have sex with men. Public Health Guidance 34, London: NICE, 2011.
- 22.↲↲Palfreeman A, Fisher M, Ong E, Wardrope J, Stewart E, Castro-Sanchez E, et al. UK national guidelines for HIV testing 2008. London: British HIV Association, 2008.
- 23.↲Heijnen A, Hermanussen R. Hiv: verdieping naast de NHG-Standaard ‘Het Soa-Consult’. Utrecht: NHG, 2013. http://www.sekshag.nl, geraadpleegd november 2016.
- 24.↲Schers H, Nieuwboer M, Molleman G, de Groot, M. Wijkgerichte aanpak in de eerste lijn werkt. Medisch Contact 2014:1323-5.
- 25.↲Landelijke Huisartsen Vereniging en Nederlands Huisartsen Genootschap. Toekomstvisie huisartsenzorg: Modernisering naar menselijke maat: Huisartsenzorg in 2022. Utrecht: LHV/NHG, 2012.
- 26.↲↲↲Joore IK, Van Roosmalen SL, Van Bergen JE, Van Dijk N. General practitioners’ barriers and facilitators towards new provider-initiated HIV testing strategies: a qualitative study. Int J STD AIDS. 2016. pii: 0956462416652274.
- 27.↲Elmahdi R, Gerver SM, Gomez Guillen G, Fidler S, Cooke G, Ward H. Low levels of HIV test coverage in clinical settings in the U.K.: a systematic review of adherence to 2008 guidelines. Sex Transm Infect 2014;90:119-24.
- 28.↲Glew S, Pollard A, Hughes L, Llewellyn C. Public attitudes towards opt-out testing for HIV in primary care: a qualitative study. Br J Gen Pract 2014;64:e60-6.
- 29.↲NHG-werkgroep Virushepatitis en andere leveraandoeningen. NHG-Standaard Virushepatitis en andere leveraandoeningen. Utrecht: NHG, 2016.
- 30.↲HIV transmission elimination Amsterdam. Amsterdam: H-TEAM, 2016. http://hteam.nl, geraadpleegd juni 2016.
Reacties
Er zijn nog geen reacties.