Kernboodschappen
- Stel de diagnose polymyalgia reumatica (PMR) bij patiënten ouder dan vijftig jaar met: * bilaterale pijn en stijfheid in nek en schoudergordel en/of heupgordel, met door de pijn veroorzaakte bewegingsbeperking, die gerekend vanaf het moment van de eerste klachten langer dan vier weken bestaan, én * ochtendstijfheid > 60 minuten, én * BSE > 40 mm/uur.
- Wees bij de diagnostiek en de controles alert op aanwijzingen voor een andere diagnose. De diagnostiek richt zich daarom grotendeels op het uitsluiten van (soms ernstige) ziektebeelden die zich op vergelijkbare wijze kunnen presenteren als PMR. Bij de controles is waakzaamheid op aanwijzingen voor een andere diagnose geboden, met name bij onvolledige of afwezige verbetering op prednis(ol)on.
- Start na het stellen van de diagnose met prednis(ol)on 15 mg/dag gedurende één maand en verminder de dosis daarna geleidelijk in één tot twee jaar.
- PMR kan gepaard gaan met arteriitis temporalis. Arteriitis temporalis is een potentieel ernstige aandoening vanwege complicaties, zoals blindheid.
- Bij aanwijzingen voor arteriitis temporalis is het noodzakelijk dat de patiënt binnen 24 uur na presentatie door de internist/reumatoloog wordt beoordeeld. Verwijs bij (geheel of gedeeltelijk) gezichtsveldverlies, acute visusdaling of dubbelzien de patiënt met spoed naar de oogarts.
Inleiding
De NHG-Standaard Polymyalgia reumatica en arteriitis temporalis geeft richtlijnen voor de diagnostiek en behandeling van polymyalgia reumatica (PMR). De standaard vervangt de Farmacotherapeutische richtlijn Polymyalgia reumatica (2006).Noot 1 De standaard besteedt daarnaast aandacht aan arteriitis temporalis voor zover deze gepaard gaat met PMR. Door het ontbreken van objectieve diagnostische criteria en een eenduidig pathofysiologisch mechanisme in combinatie met het beperkte onderscheidend vermogen van de huidige diagnostische criteria is PMR lastig af te grenzen van aandoeningen met overeenkomstige verschijnselen.Noot 2 De diagnose PMR wordt gesteld op een combinatie van klinische symptomen, verhoogde BSE en exclusie van andere, mogelijke ernstige, aandoeningen. Bij PMR treedt vaak een aanzienlijke verbetering op door behandeling met glucocorticoïden. Omdat een dergelijke verbetering ook kan optreden bij andere ziektebeelden met vergelijkbare presentatie blijft gedurende de behandeling waakzaamheid geboden. Diagnostische accuratesse is mede geboden gezien de vaak lange duur van de behandeling met glucocorticoïden en de daarmee gepaard gaande bijwerkingen. PMR kan gepaard gaan met arteriitis temporalis, waarbij hoofdpijn op de voorgrond kan staan. Doel van deze standaard is patiënten met symptomen die kunnen wijzen op PMR herkennen, voldoende betrouwbaar andere aandoeningen uitsluiten, aanbevelingen geven voor een adequate behandeling, rekening houdend met de frequent voorkomende comorbiditeit gezien de leeftijd waarop PMR voorkomt, en ten slotte arteriitis temporalis herkennen en tijdig verwijzen.Noot 3 Voor de diagnostiek en de behandeling van PMR zijn slechts beperkte gegevens uit onderzoek beschikbaar.
Achtergronden
Polymyalgia reumatica
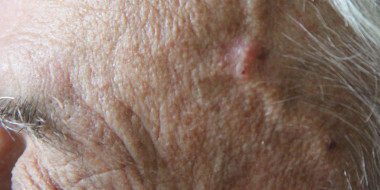
PMR is een syndroom dat wordt gekenmerkt door symmetrische pijn en stijfheid in de nek en schouderregio en/of heupgordel (zie afbeelding 1), ochtendstijfheid en (meestal) een verhoogde BSE en/of CRP.Noot 4 ,Noot 5 De diagnose kan pas worden gesteld als de klachten enige weken bestaan.6 PMR komt vrijwel uitsluitend boven het vijftigste levensjaar voor. Bij behandeling met glucocorticoïden treedt snel verbetering op; meestal zijn de klachten binnen enkele dagen tot een week grotendeels verdwenen. De meest voorkomende klacht is continue, door beweging toenemende pijn en ochtendstijfheid in de nek en schouderregio en/of bekkengordel. Deze klachten kunnen snel (in een periode van één tot zeven dagen) of meer geleidelijk ontstaan, en beïnvloeden het uitoefenen van de dagelijkse bezigheden.Noot 6 Meestal zijn de klachten beiderzijds aanwezig, maar ze kunnen asymmetrisch beginnen. Tot maximaal 50% van de patiënten heeft ook meer distaal symptomen, zoals artritis van de polsen of pitting oedeem van het distale gedeelte van de extremiteiten.Noot 7 Bij presentatie heeft ruim eenderde van de patiënten systemische verschijnselen zoals subfebriele temperatuur, malaise, vermoeidheid, anorexie en gewichtsverlies. Daarnaast kunnen een lichte normocytaire anemie (anemie bij een chronische ziekte) of afwijkende levertestwaarden worden gevonden.5 PMR heeft een uitgebreide differentiaaldiagnose, waaronder reumatoïde artritis (RA), myopathie door statines, artrose, hypothyreoïdie en maligniteiten.Noot 8 De periode vanaf het moment dat de eerste klachten zich manifesteren tot het moment dat de diagnose wordt gesteld kan één tot enkele maanden duren.Noot 9 Hoewel PMR en arteriitis temporalis samen kunnen vóórkomen, is de precieze relatie tussen PMR en arteriitis temporalis niet bekend.Noot 10 Arteriitis temporalis kan zowel vanaf het begin aanwezig zijn als zich tijdens het beloop van PMR ontwikkelen. De pathogenese van PMR is onbekend. Bij beeldvormende diagnostiek worden soms ontstekingsverschijnselen van synoviale structuren vastgesteld.Noot 11 De incidentie van PMR in de huisartsenpraktijk ligt waarschijnlijk tussen 0,5 tot 1 per 1.000 patiënten per jaar. De incidentie neemt toe met de leeftijd, de meeste gevallen doen zich voor na het zeventigste levensjaar. De ratio vrouw-man ligt tussen 2-3:1.Noot 12 PMR wordt vaker gemeld in Noord-Europese landen. 5 tot 15% van de patiënten met PMR heeft of ontwikkelt eveneens arteriitis temporalis.Noot 13 De prognose van PMR is goed. Onbehandeld is de duur van de aandoening soms meer dan vijf jaar.Noot 14 PMR kan recidiveren, maar heeft geen invloed op de levensverwachting.Noot 15
Arteriitis temporalis
Arteriitis temporalis, ook wel reuscelarteriitis genoemd, is een vasculitis. Deze kan zich, naast de meest voorkomende manifestatie in de arteria temporalis, ook op andere locaties voordoen, waarbij de grote en middelgrote arteriën die uit de aortaboog ontspringen, meestal de arteria carotis externa en de extracraniële takken van de arteria carotis interna, zijn aangetast.Noot 16 Het aantonen van de kenmerkende granulomateuze ontsteking van de vaatwand is bewijzend voor de diagnose arteriitis temporalis, waarbij soms de typische reuscellen worden aangetroffen. De incidentie van arteriitis temporalis wordt geschat op 0,2 per 1.000 patiënten boven de vijftig jaar.Noot 17 De pathogenese van arteriitis temporalis is onbekend. Arteriitis temporalis komt bijna uitsluitend voor boven het vijftigste levensjaar. Visusklachten, ischaemie door lumenvernauwing van betrokken vaten, het optreden van thoracale aneurysmata/aortadissectie en glucocorticoïdgerelateerde bijwerkingen bepalen de prognose. Van de patiënten met arteriitis temporalis heeft of ontwikkelt 40 tot 60% ook PMR. De symptomen van arteriitis temporalis zijn gerelateerd aan het systemische ontstekingsproces, de vasculaire schade door dit ontstekingsproces of door de ischemie die wordt veroorzaakt door vernauwing of occlusie van het lumen van de arterie. Het klinisch beeld kan soms vrij acuut beginnen, maar ontwikkelt zich meestal geleidelijk in enkele weken. Hoewel nieuw ontstane hoofdpijn de belangrijkste reden is voor klinisch vermoeden van arteriitis temporalis, is er geen specifiek type hoofdpijn of een andere klinische presentatie die specifiek is voor arteriitis temporalis. De meest voorkomende symptomen zijn niet eerder bekende heftige uni- of bilaterale, stekende, soms bonzende hoofdpijn, meestal bij de slapen, stekende gevoeligheid van de hoofdhuid, pijn bij het kauwen, uni- of bilaterale visusklachten en/of klachten passend bij PMR. Visusklachten kunnen bestaan uit blindheid, die aanvankelijk eenzijdig en soms in korte tijd tweezijdig kan worden, maar ook uit tijdelijk (duur enkele seconden (amaurosis fugax) tot enkele uren), soms gedeeltelijk, soms totaal visusverlies van één oog, met uiteindelijk verlies van gezichtscherpte of dubbelzien. De visusklachten kunnen voorbijgaand of blijvend zijn.Noot 18 Eenmaal opgetreden blindheid is, ondanks behandeling met glucocorticoïden, bijna altijd irreversibel, tenzij in een zeer vroeg stadium met de behandeling wordt gestart. Arteriitis temporalis kan gepaard gaan met systemische verschijnselen zoals koorts, verlies van eetlust en gewichtsverlies. Bij arteriitis temporalis passende bevindingen bij lichamelijk onderzoek zijn pijnlijke, verdikte, knobbelig aanvoelende takken van de arteria temporalis superficialis, waarvan de pulsaties niet meer voelbaar zijn en waarboven de huid rood verkleurd kan zijn. De BSE is in het algemeen verhoogd. Criteria voor arteriitis temporalis, oorspronkelijk bedoeld voor onderzoek, voldoen voor de diagnostiek niet goed.Noot 19 Bij vermoeden van arteriitis temporalis is een biopt van de arteria temporalis noodzakelijk.Noot 20 Gezien de mogelijke betrokkenheid van andere arteriën kan de diagnostiek complex zijn. Mede door de ernst van de potentiële complicaties (blindheid, thoracale aorta-aneurysma/aortadissectie) worden patiënten met verdenking arteriitis temporalis verwezen naar de internist/reumatoloog. Bij visusklachten worden patiënten met spoed verwezen naar de oogarts. Bij de behandeling van ongecompliceerde arteriitis temporalis volstaat een dosering van 40 tot 60 mg prednis(ol)on per dag. Hiermee treedt snelle verbetering van het klinisch beeld op. Bij oogheelkundige complicaties worden hogere doseringen gegeven (1 mg prednis(ol)on per kg lichaamgewicht). Bij dreigende ischaemische complicaties kan een trombocytenaggregatieremmer aan de behandeling worden toegevoegd. De behandelingsduur is één tot twee jaar. Tot op heden bestaan geen nauwkeurige voorspellers voor de duur van de behandeling.
Richtlijnen diagnostiek
Enkele weken bestaande klachten van pijn en (ochtend)stijfheid in de nek en schoudergordel en/of heupgordel bij patiënten ouder dan vijftig jaar moeten een reden zijn om aan PMR te denken.
Anamnese
Vraag bij vermoeden van PMR naar:
- pijn: lokalisatie, eenzijdig of symmetrisch, houdings- of bewegingafhankelijk of continu aanwezig; ernst/invloed van de pijn op het dagelijks leven (overeind komen uit stoel of bed, invloed op de slaap, problemen met wassen en aankleden, invloed op betaalde of onbetaalde activiteiten);
- stijfheid: lokalisatie, tijdstip van de dag, duur, invloed van de stijfheid op het dagelijks leven;
- duur van de klachten.
Vraag naar klachten die kunnen wijzen op arteriitis temporalis:
- hoofdpijn: bekende of onbekende hoofdpijn, lokalisatie, enkel- of dubbelzijdig;Noot 21
- pijn bij het kauwen, pijn bij haren kammen;
- visusproblemen: gedeeltelijk of totaal gezichtsveldverlies, snel ontstane visusdaling, enkel- of dubbelzijdig, voorbijgaand of permanent, dubbelzien.
Besteed voor andere oorzaken van de klachten dan PMR of arteriitis temporalis aandacht aan:
- aanwezigheid van gezwollen gewrichten of peesscheden (RA);
- temperatuur (infectie);
- malaise, verlies van eetlust, gewichtsverlies, rugpijn, hoesten (maligniteit, hypothyreoïdie);
- verloop van de klachten in de tijd: wanneer begonnen, waarmee begonnen, voorafgaande klachten, snel ontstaan of meer geleidelijk (infectie, maligniteit, aspecifieke klachten van het bewegingsapparaat);
- gebruik van statines, spierzwakte (myopathie).Noot 22
Lichamelijk onderzoek
Het lichamelijk onderzoek richt zich vooral op aanwijzingen voor PMR en arteriitis temporalis. Afhankelijk van de bevindingen bij de anamnese en het lichamelijk onderzoek kan een uitgebreider lichamelijk onderzoek, gericht op andere oorzaken, noodzakelijk zijn. Besteed beiderzijds aandacht aan:
- actief bewegingsonderzoek van nek, schouders, heupen: let op pijn, beperkingen en de aanwezigheid van krachtverlies (myopathie);
- perifere artrogene en tendinomyogene afwijkingen: gevoeligheid gewrichtskapsels van knie, pols en vinger- en handgewrichten, zwellingen ter plaatse gewrichten vinger/hand (RA), zwelling van dorsale zijde hand of pols voeten, enkels, aanwijzingen carpaletunnelsyndroom;
- gevoeligheid, pijn of zwelling bij palpatie arteria temporalis, aanwezigheid pulsaties arteria temporalis.Noot 23
Aanvullende diagnostiek
Bepaal de BSE en verricht bij een verhoogde BSE verder aanvullend bloedonderzoek.5 Exacte richtlijnen voor het aanvragen van verdere aanvullende diagnostiek zijn niet te geven.Noot 24 Vraag de volgende onderzoeken aan:
- bloedbeeld (infectieziekten, maligniteit);
- TSH;
- totaal eiwit en eiwitspectrum (multipel myeloom);Noot 25
- CK (myopathie door statines, poly-/dermato-myositis).
Evaluatie
Sluit veel voorkomende aandoeningen, die zich op ongeveer dezelfde wijze kunnen presenteren als PMR, uit voordat de diagnose PMR wordt gesteld:
- (late-onset) reumatoïde artritis: één of meer gezwollen gewrichten, in combinatie met pijn, stijfheid, warmte, roodheid of bewegingsbeperking, tangentiële drukpijn van de MCP’s of MTP’s; ochtendstijfheid van dertig minuten of meer, duur van de klachten langer dan vier weken, ondanks behandeling met een NSAID. Soms is langere follow-up nodig om de correcte diagnose te stellen;Noot 26
- hypothyreoïdie (TSH).
Stel, wanneer de klachten redelijkerwijs niet kunnen worden verklaard door een andere oorzaak, de diagnose PMR bij patiënten ouder dan vijftig jaar en:
- duur van klachten, gerekend vanaf het moment van de eerste klachten, langer dan vier weken,6 én
- bilaterale pijn in nek en schoudergordel en/of heupgordel (door de pijn veroorzaakte actieve bewegingsbeperking van schouders en/of beperkingen van actieve bewegingen van de heupen; vaak ‘s nachts veel last en moeite met aankleden en overeind komen), én
- ochtendstijfheid > 60 min, én
- BSE > 40 mm/uur.
Richtlijnen beleid
Voorlichting en advies
- PMR is een aandoening waarbij de nek en schouderregio en/of heupgordel stijf en pijnlijk zijn, vooral in de ochtend. De oorzaak is onbekend.
- Bij de behandeling van PMR zijn meestal glucocorticoïden noodzakelijk. Doorgaans treedt daarmee snel verbetering op en geneest de ziekte uiteindelijk zonder restschade. Om te voorkomen dat de klachten van PMR terugkomen, moet de behandeling met glucocorticoïden in het algemeen één tot twee jaar worden voortgezet. Regelmatige controle is noodzakelijk ter evaluatie van het effect van de medicatie op de klachten. Glucocorticoïden mogen niet ineens gestaakt worden.
- PMR kan gepaard gaan met arteriitis temporalis. Hierbij komt hoofdpijn voor, die anders wordt ervaren dan gewone hoofdpijn. Soms treedt deze hoofdpijn op bij kauwen en kunnen er problemen met het gezichtsvermogen optreden, zoals snel ontstane visusdaling, dubbelzien of blindheid. Snelle behandeling met glucocorticoïden kan dan verdere schade voorkomen of de schade beperkt houden. Ter ondersteuning van de voorlichting kan de huisarts gebruikmaken van de NHG-Patiëtenbrief PMR (zie www.nhg.org).
- bij koorts (door het gebruik van glucocorticoïden kan immunosuppressie, bijnierschorsinsufficiëntie en een verstoring van het klinisch beeld optreden);
- bij niet bekende hoofdpijn;
- bij acute visusdaling, (eenzijdig, soms kortdurend) visusverlies of dubbelzien.
Niet-medicamenteuze therapie
De werkzaamheid van fysiotherapie bij PMR is niet onderzocht.Noot 28
Medicamenteuze therapie
Patiënten met PMR worden behandeld met orale glucocorticoïden.Noot 29 Het doel van de behandeling is afwezigheid van klachten.
Het volgende behandelingsschema voor de eerste drie maanden wordt geadviseerd: (zie tabel 1):Noot 30
- start met prednis(ol)on 15 mg eenmaal daags, gedurende een maand. Na één maand dienen pijn en stijfheid verdwenen te zijn en dient de bezinking gedaald te zijn tot onder de 40 mm/uur. Ook bij eerdere verbetering wordt de aanvangsdosering gecontinueerd tot minimaal twee weken na het verdwijnen van de klachten;
- verminder de dagdosering vervolgens iedere vier weken met 2,5 mg tot een dagdosering van 10 mg is bereikt.
Voor de vermindering van de dosering ná de eerste drie maanden behandeling zijn geen goede richtlijnen te geven, omdat het beloop kan verschillen. Baseer de vermindering van de dosering op de volgende overwegingen:
- een zeer geleidelijke vermindering van de dagdosering geeft de minste kans op terugval;
- de fase waarbij de medicatie in nog zeer lage dosering wordt gegeven tot het moment van stoppen kan langdurig zijn; veel patiënten ervaren in die periode een terugval;
- verhoog bij het terugkeren van de klachten of het oplopen van de BSE, zonder verklaarbare andere oorzaak, de dagdosering naar het niveau waarop de klachten afwezig of acceptabel waren. Probeer na vier weken de dosering opnieuw te verlagen;
- De duur van de behandeling kan variëren van één tot twee jaar. Een kleine groep patiënten heeft gedurende een langere periode een lage dosering nodig.
Aandachtspunten bij de behandeling met glucocorticoïden:
- Glucocorticoïden zijn immunosuppressief. Wees daarom alert op aanwijzingen voor infecties of reactivering van latent aanwezige infecties zoals TBC.Noot 31 Instrueer de patiënt bij koorts (> 38,0 °C) contact op te nemen.
- Langdurig gebruik van glucocorticoïden kan suppressie van de bijnierschorsactiviteit geven.Noot 32
- Osteoporose. Geef bij de behandeling met glucocorticoïden bisfosfonaten volgens de richtlijnen in de NHG-Standaard Osteoporose en staak de bisfosfonaten bij het beëindigen van de behandeling met glucocorticoïden. Overweeg, eveneens conform deze standaard, aanvullende preventieve behandeling met calcium en vitamine D.
- Gastro-intestinale ulceraties. Wanneer alleen glucocorticoïden worden gebruikt, is er geen maagbescherming aangewezen. Bij een ulcus pepticum in de anamnese of bij aanwezigheid van een andere risicofactor zoals het gebruik van NSAID’s, SSRI's, salicylaten of anticoagulantia is maagbescherming geïndiceerd. (zie NHG-Standaard Maagklachten).Noot 33
Controles
Controleer de patiënt regelmatig en gedurende lange tijd na het stellen van de diagnose PMR. De aanwezigheid en de ernst van de klachten en de bezinking (BSE) worden gebruikt om het ziekteproces te vervolgen.Noot 34 Heroverweeg de diagnose als het klachtenpatroon en/of de BSE niet naar verwachting afneemt of bij toename van de klachten of stijging van de BSE ondanks behandeling. Het is raadzaam de klachten en bevindingen goed vast te leggen om het beloop te kunnen volgen.
De huisarts hanteert het volgende controleschema na de start van de behandeling:
- één week en vier weken na de start van de behandeling. Na één week mag reeds verbetering verwacht worden;4
- één tot vier weken na iedere dosisverandering.
Beoordeel bij de controles de situatie ten opzichte van de vorige controle en bepaal of er verbetering, geen verandering of verslechtering is opgetreden. Hierbij komen aan de orde:Noot 35
- pijn en stijfheid in de nek en schoudergordel en/of heupgordel (vraag naar: overeind komen uit stoel of bed, invloed op de slaap, problemen met wassen en aankleden, en onderzoek of de patiënt actief de armen of benen kan heffen), globale indruk door de huisarts. Eventueel kan de patiënt met een score op een visueel analoge schaal (VAS) het beloop van zijn ziekte inzichtelijk maken;
- ochtendstijfheid (in minuten);
- nieuwe klachten of symptomen, passend bij een alternatieve diagnose. Let vooral op klachten passend bij arteriitis temporalis, zoals hoofdpijn, visusklachten en pijn bij kauwen, omdat arteriitis temporalis zich tijdens het beloop van PMR kan ontwikkelen. Instrueer de patiënt bij deze klachten direct contact op te nemen;
- de medicatie: bijwerkingen, zoals het optreden van maagklachten of problemen met het innameschema.
Bepaal:
- De BSE vier weken na de start van de behandeling. Controleer daarna de BSE één tot vier weken na iedere dosisverandering. De BSE daalt onder invloed van prednis(ol)on naar een normale waarde. Voor een eventuele individuele referentiewaarde van de BSE kan een eerder bepaalde BSE behulpzaam zijn. Heroverweeg de diagnose of stel het afbouwschema bij als de (meerdere malen gemeten) BSE oploopt.
- De nuchtere glucose voorafgaand aan de start van de behandeling met prednis(ol)on en drie tot zeven dagen daarna. Bepaal bij het ontstaan van hyperglykemie de glucosespiegel frequent en start behandeling en controles conform de NHG-Standaard Diabetes Mellitus Type II. Pas zo nodig de diabetesmedicatie aan bij de geleidelijke dosisvermindering van prednis(ol)on. Geef voorlichting over verschijnselen die passen bij hyperglykemie en wat patiënten dan kunnen doen. Vergelijkbare aanbevelingen gelden voor patiënten met bekende diabetes mellitus.
Tussentijdse overwegingen:
- Bij een deel van de patiënten zal gedurende de behandeling een terugval optreden. Hiervan is sprake wanneer de klachten een verhoging van de glucocorticoïddosering noodzakelijk maken.Noot 36
- Bij geen verbetering op glucocorticoïden na de eerste weken van de behandeling en ook bij het ontstaan van verschijnselen gedurende de behandeling die niet passen bij PMR of arteriitis temporalis moet een alternatieve diagnose worden overwogen.
- Veel patiënten vertonen weliswaar een goede verbetering door behandeling, maar worden niet compleet klachtenvrij.
Verhoog bij het terugkeren van de klachten en symptomen of het oplopen van de BSE zonder aantoonbare andere oorzaak de glucocorticoïddosering naar het laagste niveau waarbij de klachten nog afwezig waren. Probeer hierna bij verbetering van de klachten na vier weken de dosering opnieuw te verlagen.
Verwijzing of consultatie
Verwijs:
- bij vermoeden van arteriitis temporalis naar een reumatoloog/internist voor beoordeling binnen 24 uur na presentatie. De reden hiervoor is dat oogheelkundige complicaties zich snel kunnen ontwikkelen en bijna altijd irreversibel zijn. Huisartsen hebben daarnaast relatief weinig ervaring met het stellen van de diagnose op het klinisch beeld;
- bij een acute visusdaling, (geheel of gedeeltelijk) gezichtsveldverlies of dubbelzien met spoed naar de oogarts;
- bij ernstige bijwerkingen van of contra-indicaties voor langdurig gebruik van glucocorticoïden naar de reumatoloog/internist voor een eventuele behandeling met methotrexaat. 33,35,Noot 37
Verwijs naar of consulteer een reumatoloog/internist:
- bij uitblijven van klinische verbetering na één week behandeling of afwezigheid van duidelijke klinische én biochemische verbetering binnen vier weken na start van de behandeling;
- bij regelmatige terugval (> 2 maal per jaar);
- als het niet mogelijk is de glucocorticoïddosering te verminderen;
- bij twijfel aan de diagnose.
| Moment vanafstart behandeling | Dosering prednis(ol)on |
|---|---|
| Week 0 - 4 | 15 mg per dag |
| Week 4 - 8 | 12,5 mg per dag |
| Week 8 - 12 | 10 mg per dag |
| Vanaf week 12 | Op geleide van klachten zeer geleidelijke vermindering van de dosering. Zie voorbeeldschema afbouw prednis(ol)on in de bijlage bij de standaard op www.nhg.org. |
| Terugval | Verhoog bij het terugkeren van de klachten en symptomen of het oplopen van de BSE, zonder verklaarbare andere oorzaak, de dagdosering naar het niveau waarop de klachten afwezig of acceptabel waren. Probeer na 4 weken de dosering opnieuw te verlagen. |
Totstandkoming
In juli 2008 startte een werkgroep van zes huisartsen en een internist-klinisch geriater met het schrijven van de NHG-Standaard Polymyalgia reumatica en arteriitis temporalis. De werkgroep bestond uit de volgende leden: M.J.P. Ballieux, huisarts te Nieuwegein en wetenschappelijk medewerker van de afdeling Implementatiematerialen van het Nederlands Huisartsen Genootschap; R.H. Dijkstra, huisarts te Monnickendam; L. Hakvoort, huisarts te Groningen; H.J. Meijman, huisarts te Amsterdam; P.J. Weisscher, huisarts te Nieuwegein; B.G. Willemse, huisarts te Den Haag en P. Dubbeld, internist-klinisch geriater. Er werd geen belangenverstrengeling gemeld. De begeleiding van de werkgroep en de eindredactie berustten bij W.H. Eizenga, huisarts en wetenschappelijk medewerker van de afdeling Richtlijnontwikkeling en Wetenschap van het Nederlands Huisartsen Genootschap. Dr. R.M.M. Geijer was betrokken als senior-wetenschappelijk medewerker. Dr. J.W.G. Jacobs, reumatoloog, gaf commentaar op het eerste concept van deze standaard. In mei 2009 werd de ontwerpstandaard becommentarieerd in een focusgroepsessie met zes huisartsen, die allen erkend kwaliteitscoördinator zijn. Tevens werd commentaar ontvangen van een aantal referenten, te weten: E. Lüning, specialist ouderengeneeskunde namens Verenso; Z. Erjavec, internist-hematoloog en dr. C.F. Allaart, internist-reumatoloog namens de NIV; prof.dr. W.F. Lems, reumatoloog namens de NVR; E. van Leeuwen en P. Koeck namens de Domus Medica; dr. C.T.J. Hulshof namens de NVAB; K. de Leest, dr. E.J. Vollaard, B.J.F. van den Bemt, apothekers en dr. A.L.M. Kerremans, klinisch-farmacoloog namens de WINAp; A.J. Arends en M.J. van Hengel, klinisch geriaters namens de NVKG; B.A.E. van der Pol, oogarts namens het NOG; prof.dr. J.M.A. Sitsen, arts-klinisch farmacoloog namens het CvZ; prof.dr. T. Lagro-Janssen, hoogleraar vrouwenstudies medische wetenschappen en als huisarts werkzaam bij het UMC St Radboud; J. Winters, J. van Dongen en E. Lemaire, huisartsen namens de NHG-adviesraad Standaarden. Vermelding als referent betekent overigens niet dat iedere referent de standaard inhoudelijk op elk detail onderschrijft. In oktober 2009 werd de standaard becommentarieerd en geautoriseerd door de NHG-Autorisatiecommissie. De zoekstrategie die gevolgd werd bij het zoeken naar de onderbouwende literatuur is te vinden bij de webversie van deze standaard. Ook zijn de procedures voor de ontwikkeling van NHG-Standaarden in te zien in het procedureboek (zie www.nhg.org).
© 2010 Nederlands Huisartsen Genootschap
Voetnoten
- Noot 1.↲
De huidige standaard vervangt de Farmacotherapeutische richtlijn Polymyalgia reumatica uit 2006, die een meer beschrijvend karakter had. De standaard gaat met name uitgebreider in op de differentiaaldiagnose van polymyalgia reumatica en geeft duidelijkere aanbevelingen. Daarnaast is de standaard voorzien van een uitgebreid notenapparaat.
- Noot 2.↲
Valkuilen bij de diagnosestelling van PMR In een retrospectief cohortonderzoek (1994 tot 2003) in drie grote huisartsenpraktijken in Engeland werd gekeken welke symptomen leidden tot de diagnose PMR. Daarnaast werden deze bevindingen vergeleken met bestaande sets van criteria voor de diagnose PMR (Bird, Jones/Hazleman, Hunder en Healey). Tot slot werd bekeken welke bevindingen bij de diagnosestelling van invloed waren op de uitkomst. Patiënten met verschijnselen van arteriitis temporalis werden geëxcludeerd. Er werden 183 patiënten met PMR geïdentificeerd. BSE > 30mm/uur en CRP > 6 mg/l werden gekenschetst als afwijkend. De gemiddelde leeftijd waarop de diagnose werd gesteld was 75 jaar. 75% van de patiënten was vrouw, 11% van de patiënten had een normale BSE en CRP. Bij 91% van de patiënten droeg een succesvolle proefbehandeling met corticosteroïden bij aan de diagnose. De diagnose werd verder ondersteund door verhoogde ontstekingsparameters (90%), spierpijn van het proximale deel van de extremiteit (82%) en normalisatie van de ontstekingsparameters (81%) tijdens behandeling. Bij 19% was ochtendstijfheid vastgelegd. De gemiddelde behandelduur was 1,4 jaar. De gemiddelde startdosering was 15 mg/dag prednisolon. Twee variabelen waren onafhankelijk geassocieerd met een langere behandelduur: vrouwelijk geslacht (OR 1,5) en verhoogde ontstekingsparameters (OR 2,0). 14% van de patiënten werd verwezen naar de tweede lijn. Slechts 25 van de 183 patiënten voldeden geheel aan één van de bestaande sets van criteria. Binnen twee jaar na de diagnose PMR hadden 22 patiënten (12%) een andere diagnose: negen patiënten RA, zeven een maligniteit en zes hypothyreoïdie. RA en hypothyreoïdie werden frequenter aangetroffen dan verwacht in de normale populatie. In de helft van de gevallen werd de diagnose binnen twee weken na het begin van de klachten gesteld. Hiermee bestaat de kans dat self-limiting ziekten (postvirale klachten) te snel als PMR worden behandeld. Het vastleggen van ochtendstijfheid kan belangrijk zijn om een onderscheid te kunnen maken tussen inflammatoire pijnklachten (PMR, RA) en niet-inflammatoire pijnklachten (cervicale artrose). Bij 25 patiënten werd een dosering gehanteerd die hoger was dan de gebruikelijke dosis van 20 mg of lager. Dit kan leiden tot maskeren van klachten die bij een alternatieve diagnose zou kunnen passen [Barraclough 2008].
- Noot 3.↲
Onderdiagnostiek Bahlas et al. voerden een retrospectief dossieronderzoek uit bij 123 door huisartsen naar een derdelijns reumatologische kliniek (Canada) verwezen patiënten bij wie uiteindelijk de diagnose PMR werd gesteld. Slechts bij 25% van de ingestuurde patiënten veronderstelde de huisarts in de verwijsbrief PMR [Bahlas 2000].
- Noot 4.↲
Criteria PMR Ondanks overeenstemming over het klinisch beeld zijn er geen standaard tests of algemeen geaccepteerde criteria voor PMR. Verschillende sets van diagnostische criteria worden in de literatuur beschreven (Bird, Jones/Hazleman, Hunder, Healey, Chuang). Vooral de criteria van Bird en van Jones/Hazleman, hoewel de laatste met name bedoeld waren als inclusiecriteria voor trials, worden in de literatuur veelvuldig gebruikt. Ook over de behandeling bestaat geen consensus. Verbetering door corticosteroïden werd in twee sets van diagnostische criteria als belangrijk kenmerk gezien (Jones-Hazleman, Healey). Anderen vonden juist dat met introductie van dit kenmerk de kans op diagnostische fouten toenam [Brooks 1997]. Het gebrek aan overeenstemming rond de diagnostische criteria maakt ook onderzoeken rond PMR onderling moeilijker vergelijkbaar. Een internationale werkgroep is ingesteld om criteria voor PMR vast te stellen, onder auspiciën van de American College of Rheumatology en European League Against Rheumatism. De ontwikkeling van criteria heeft tot doel PMR te onderscheiden van andere ziekten met een vergelijkbare presentatie. In drie Delphi consensusrondes, aanvankelijk met experts en later met reumatologen en niet-reumatologen, is een set van zeven criteria vastgesteld, waarvan in prospectief onderzoek de bruikbaarheid moet worden vastgesteld: leeftijd > 50 jaar, duur klachten > 2 weken, bilaterale pijn aan schouder- en/of heupgordel, ochtendstijfheid > 45 min, verhoogde BSE, verhoogde CRP, snelle klinische en biochemische respons (> 75% globale respons < 1 week) op predniso(lo)n 15 tot 20 mg/dag [Dasgupta 2008]. [[tbl:2814]]
- Noot 5.↲
BSE en CRP bij diagnostiek en follow-up De BSE kan, onafhankelijk van een ziekteproces, worden beïnvloed door geslacht, leeftijd en medicatiegebruik. Referentiewaarden van de bovengrens van de BSE zijn vastgesteld voor personen onder of boven de vijftig jaar. De LESA Rationeel aanvragen van laboratoriumdiagnostiek hanteert voor vrouwen onder en boven de vijftig jaar een bovengrens van 20 mm/uur respectievelijk 30 mm/uur en voor mannen onder en boven de vijftig jaar van 15 mm/uur respectievelijk 20 mm/uur (zie www.nhg.org). De BSE en de CRP worden beide als parameter gebruikt bij de diagnostiek en de follow-up van PMR. PMR kan voorkomen zonder verhoogde BSE. In verschillende (retrospectieve) patiëntenseries wordt bij 7 tot 22% een normale BSE gevonden. Het gebruikte afkappunt voor de BSE varieert tussen 30 tot 40 mm/uur. In een overzichtsartikel worden de volgende kenmerken van de groep PMR met lage BSE genoemd: relatief jongere leeftijd, langere duur van klachten voor het stellen van de diagnose, minder systemische verschijnselen, minder voorkomen van laboratoriumafwijkingen zoals anemie. Daarentegen was er geen verschil in aantal malen terugval of de prevalentie van reumatoïde artritis vergeleken met de groep met verhoogde BSE. Opmerkelijk was dat in de groep met PMR en een normale BSE niemand een arteriitis temporalis ontwikkelde [Martinez-Taboada 2000]. Het merendeel van de patiënten met PMR en een normale BSE blijkt wel een verhoogde CRP te hebben [Cantini 1998]. In een prospectief follow-uponderzoek in een tweedelijns centrum voor reumatologie (Italië) werd bij 177 opeenvolgende patiënten met PMR (criteria van Healey) bij de diagnostiek en gedurende de follow-up de BSE (Westergren methode) en CRP gemeten. Voor leeftijd en geslacht gematchte gezonde personen dienden als controles. Van de patiënten (voornamelijk mannen) had 8,5% een normale BSE (< 40 mm/uur) bij het stellen van de diagnose en 1,1% een normale CRP < 0,5 mg/dl). Patiënten met een hogere BSE hadden meer systemische verschijnselen. Voor de kans op terugval was de BSE bij diagnosestelling een betere voorspeller dan de CRP. De CRP daarentegen was een meer sensitieve indicator voor de huidige activiteit van de ziekte [Cantini 2000]. In een gecombineerd prospectief en retrospectief Noors onderzoek bij patiënten met PMR (n = 268) bleek dat de BSE (> 40 mm/uur) bij 97,7% van patiënten verhoogd was en CRP (? 10 mg/l) bij 94,8%. Bij 1,5% van de patiënten waren zowel BSE als CRP normaal. Daarnaast werden afwijkende leverenzymen gevonden: in 13,8% van de gevallen ging het om een verhoging van de ALAT, in 29,2% om een verhoging van de gGT en in 8,5% om een verhoging van de AF [Myklebust 1996]. Conclusie: in verschillende onderzoeken betreffende PMR wordt de bepaling van de CRP, naast of in plaats van de BSE, aanbevolen. Ook wordt gesteld dat de CRP een meer sensitieve indicator van de activiteit van PMR is dan de BSE en bruikbaar kan zijn bij de diagnostiek en follow-up van de ziekte. De werkgroep kiest voor het gebruik van de BSE bij de diagnostiek en de follow-up van polymyalgia reumatica om de volgende redenen: de CRP heeft geen meerwaarde boven de BSE, met het gebruik van de BSE bij PMR bestaat veel ervaring in de huisartsenpraktijk, de bepaling van de BSE is gemakkelijk (in de praktijk) uit te voeren en het gebruik van de BSE sluit aan bij reeds bestaande criteria.
- Noot 6.↲
Eerste symptomen van PMR en/of arteriitis temporalis en klachten bij presentatie In een gecombineerd prospectief (n = 287) en retrospectief onderzoek (n = 48) in Noorwegen werden patiënten met PMR en/of arteriitis temporalis (door reumatoloog vastgesteld op basis van criteria van Bird of Hamrin voor PMR of criteria van de ACR voor arteriitis temporalis) gevolgd tot het moment van stoppen van de therapie en complete remissie [Myklebust 1996]. In de prospectieve groep hadden 233 patiënten PMR (81,2%), 39 patiënten arteriitis temporalis zonder PMR (13,6%) en 15 patiënten PMR én arteriitis temporalis (5,2%). In de retrospectieve groep hadden 19 patiënten PMR, 10 patiënten arteriitis temporalis en 2 patiënten beide. De combinatie van arteriitis temporalis en PMR kwam bij vrouwen tweemaal zo vaak voor als bij mannen. De gemiddelde leeftijd bij het optreden van de ziekte was 71,7 jaar (spreiding 53 tot 89 jaar). Onderscheiden werden de eerste symptomen van de ziekte en de symptomen op het moment van presentatie bij de arts. Bij PMR was de meest voorkomende klacht pijn en stijfheid van de schouderregio (21% aanwezig bij eerste symptomen van de ziekte en 78% bij presentatie); voor pijn en stijfheid van de heupgordel was dit respectievelijk 16 en 65%. In minder dan een kwart van de gevallen waren er klachten van pijn en stijfheid van de nek, schouder, proximale armen, heupen en bovenbenen als eerste verschijnselen van de ziekte, terwijl bij presentatie het merendeel van de patiënten deze klachten had. Nachtzweten en gewichtsverlies werden weinig gemeld als eerste symptomen van de ziekte en werden in respectievelijk 42 en 29% van de gevallen bij de eerste presentatie gemeld. Bij arteriitis temporalis was hoofdpijn bij 54% van de patiënten het eerste verschijnsel van de ziekte, terwijl dit bij presentatie 85% was. In een kwart van de gevallen ging het hierbij om temporale hoofdpijn. Bij presentatie was occipitale hoofdpijn bijna net zo vaak aanwezig als temporale hoofdpijn. Het onderzoek vermeldt niet of het om enkel of dubbelzijdige hoofdpijn ging. Bij PMR had ongeveer 25% van de patiënten klinisch aantoonbare ontsteking van de perifere gewrichten (60% knie, 36% pols, 38% hand en 9% enkel, 8% sternoclaviculair en 2% heup). 4% had polyartritis. Bij arteriitis temporalis was geen perifere artritis aanwezig. Eén patiënt met arteriitis temporalis had beiderzijds een compleet verlies van de visus en zeven patiënten met arteriitis temporalis meldden dat ze enig visusverlies hadden gehad. Er bleken geen significante verschillen in klinische presentatie tussen mannen en vrouwen. In meer dan de helft van de patiënten met PMR was het begin van de klachten acuut (56,3%), bij arteriitis temporalis (of de combinatie van arteriitis temporalis en PMR) was dit 74,5%. Conclusie: bij presentatie bij de dokter had het merendeel van de patiënten met PMR klachten van de schouderregio en de heupgordel, maar ook van de nek, bovenarmen en bovenbenen. Bij arteriitis temporalis is hoofdpijn de meest frequente klacht bij presentatie.
- Noot 7.↲
Distale manifestaties van PMR In een prospectief follow-uponderzoek (twee reumatologische klinieken in Italië) van 177 opeenvolgende patiënten met PMR (Healey criteria) over een periode van vijf jaar hadden 45% van de patiënten distale articulaire en/of tenosynoviale symptomen bij de diagnose en gedurende de follow-up, 25% had een perifere artritis, 14% een CTS, 12% pitting oedeem van het distale deel van een extremiteit. In 31% van de gevallen waren distale manifestaties de enige uiting van een recidief [Salvarani 1998]. In een prospectief follow-uponderzoek in de tweede lijn (Italië) (n = 74) werd bij 51% een distale manifestatie van PMR (criteria Chuang) gevonden: 39% perifere synovitis (met name pols, MCP-gewrichten en knie), 5% pitting oedeem van de hand, 5% CTS en 1,3% distale tenosynovitis [Ceccato 2006]. In een tweedelijnsonderzoek (n = 287; Noorwegen) had ongeveer 25% van de patiënten met PMR een klinisch aantoonbare ontsteking van de perifere gewrichten [Myklebust 1996]. Conclusie: distale manifestaties van PMR, zoals artritis van perifere gewrichten, oedeem van hand of voet, carpaletunnelsyndroom en tenosynovitis, komen bij maximaal 50% van de patiënten voor. Deze kunnen aanwezig zijn vanaf het begin van de ziekte, maar ook (soms de enige) uiting zijn van een recidief.
- Noot 8.↲
Differentiaaldiagnose van PMR Veel ziekten kunnen op PMR lijken, doordat ze gepaard gaan met myalgie. In een aantal overzichtsartikelen worden de volgende ziektebeelden genoemd in de differentiaaldiagnose van PMR: degeneratieve aandoeningen (zoals artrose, frozen shoulder), endocriene aandoeningen (hypothyreoïdie, hyperparathyreoïdie), infectieziekten ((prodromen van) virusziekten, TBC, endocarditis), inflammatoire systemische ziekten (RA, SLE, polymyositis), spierziekten (myopathie), maligniteit (hematopoietische maligniteiten, waaronder multipel myeloom en leukemie, longcarcinoom, carcinomen van urologische origine, ovariumcarcinoom, prostaatcarcinoom, coloncarcinoom, maagcarcinoom en pancreascarcinoom), neurologische aandoeningen (ziekte van Parkinson, myasthenie), psychiatrische zieken (depressie), bijwerkingen van medicatie (myositis door statines) en overige aandoeningen zoals fibromyalgie [Bird 2005; Brooks 1997; Gonzalez-Gay 2000].
- Noot 9.↲
Diagnostisch delay In een Noorse prospectief onderzoek van 287 door de huisarts verwezen patiënten met PMR en/of arteriitis temporalis bleek het gemiddelde diagnostische delay vanaf de eerste klachten tot de diagnose bij patiënten met PMR 2,9 maanden (spreiding 0,25 tot 18), bij de combinatie van PMR en arteriitis temporalis 1,9 maanden (0,5 tot 5) en bij arteriitis temporalis 1,5 maanden (0,25 tot 7) [Myklebust 1996].
- Noot 10.↲
De relatie tussen PMR en arteriitis temporalis Sommigen zien PMR en arteriitis temporalis als verschillende fases van dezelfde ziekte, anderen postuleren dat het om verschillende, maar vaak ook overlappende, ziektebeelden gaat. Hoewel het klinisch beeld anders is, gaan beide aandoeningen gepaard met een verhoogde BSE/CRP, systemische verschijnselen en snelle verbetering op glucocorticoïden. In een review werd het bewijs rond de relatie tussen PMR en arteriitis temporalis beschreven [Cantini 2004]. Geconcludeerd werd dat PMR en arteriitis temporalis met enige regelmaat samen voorkomen, maar dat de onderliggende oorzaak hiervan onduidelijk is.
- Noot 11.↲
Pathofysiologie PMR Het is niet duidelijk of het pathofysiologisch mechanisme bij PMR een vasculitis, een synovitis of een combinatie van beide is. Uit beeldvormende diagnostiek blijkt dat het ontstekingsproces bij PMR zich afspeelt in extra-articulaire structuren, meestal de bursae bij gewrichten [Cantini 2008; Pavlica 2000].
- Noot 12.↲
Incidentie PMR Er is een grote variatie in de incidentie van PMR in verschillende onderzoeken. Verklaringen voor deze variatie kunnen zijn: een gebrek aan uniforme criteria voor de diagnose PMR, het meer of minder gespitst zijn op de diagnose of een daadwerkelijke geografische variatie. In een review over de epidemiologie van PMR bleek dat in Scandinavische onderzoeken, maar ook in onderzoeken uit de VS in populaties van Angelsaksische (Kaukasische) afkomst, tienmaal hogere incidenties van PMR werden gevonden dan in onderzoeken uit Zuid-Europa (1,13/1.000 versus 0,12/1.000). Daarbij werd een positieve correlatie gevonden tussen de incidentie en de breedtegraad waarop het onderzoek werd uitgevoerd. Ook nam de incidentie in de loop van de tijd toe [Cimmino 2000]. In de meeste patiëntenseries zijn niet-blanken nauwelijks vertegenwoordigd. Bij mensen van Afrikaanse afkomst komen PMR en arteriitis temporalis wel voor; bij hen lijken PMR en arteriitis temporalis zich op dezelfde manier als bij de blanke (Kaukasische) populatie te presenteren, hetzelfde beloop te hebben en ze lijken op dezelfde manier te reageren op behandeling [Goodwin 1990]. Bij analyse van EMD’s van huisartsenpraktijken in Groot-Brittannië (GPRD) over de periode 1990 tot 2001 bleek de incidentie van PMR 0,84 (95%-BI 0,83 tot 0,86) per 1.000. De ratio vrouw/man was 2,0. De incidentie nam toe van 0,69/1.000 in 1990 naar 0,93/1.000 in 2001. De incidentie steeg sterk met de leeftijd: van 0,98/1.000 bij 60- tot 69-jarigen naar 22,9/1.000 bij 70- tot 79-jarigen en 22,2/1.000 bij mensen boven de 80 jaar. De gemiddelde leeftijd waarop de diagnose werd gesteld was 72,7 jaar. De incidentie van arteriitis temporalis bleef in de periode 1990 tot 2001 nagenoeg gelijk 0,22 (95%-BI 0,21 tot 0,23) Opmerkelijk is dat de incidentie in het zuiden van Groot-Brittannië hoger was dan in het noorden [Smeeth 2006]. In de Nederlandse Continue Morbiditeitsregistratie (CMR) werden in zestien jaar tijd (1985 tot 2001) 95 gevallen van PMR geregistreerd met een incidentie van 0,2/1.000 bij mannen en 0,7/1.000 bij vrouwen. In ruim driekwart (76/95) van de gevallen ging het om patiënten ouder dan 65 jaar [Van de Lisdonk 2008].
- Noot 13.↲
Vóórkomen arteriitis temporalis bij PMR Uit dossieronderzoek in de eerste lijn in Groot-Brittannië over de periode 1990 tot 2001 werden 15.013 patiënten met de diagnose PMR en 3928 patiënten met de diagnose arteriitis temporalis geïdentificeerd. Bij 5,2% van de patiënten werd, voordat de diagnose PMR werd gesteld, de diagnose arteriitis temporalis gesteld. Bij 2,5% van de patiënten werd de diagnose arteriitis temporalis gesteld nadat de diagnose PMR was gesteld. Bij de 3928 patiënten met de diagnose arteriitis temporalis werd bij 14,9% voorafgaand de diagnose PMR vastgesteld en bij 14,2% achteraf [Smeeth 2006].
- Noot 14.↲
Natuurlijk beloop van PMR Het natuurlijk beloop van reumatoïde artritis zonder artritis, vanaf 1957 door Barber PMR genoemd, wordt in een aantal onderzoeken, voordat behandeling met glucocorticoïden gebruikelijk was, beschreven. Verondersteld wordt dat dit drie maanden tot 35 jaar kon duren, met een gemiddelde duur van 7,1 jaar [Bagratuni 1956; Bagratuni 1963; Barber 1957].
- Noot 15.↲
Associatie PMR en de behandeling met glucocorticoïden met HVZ en mortaliteit. Om vast te stellen of patiënten met PMR een vergroot risico hebben op perifere arteriële vaatziekten werd een cohort van patiënten met PMR (n = 353) vergeleken met patiënten zonder PMR. Iedere patiënt met PMR werd vergeleken met twee patiënten zonder PMR. De 353 PMR-patiënten hadden een gemiddelde leeftijd van 73,3 jaar, 67% was vrouw. De 705 patiënten zonder PMR hadden een gemiddelde leeftijd van 73,2 jaar en 68% was vrouw. Meer dan 95% van de patiënten was blank. De gemiddelde follow-up was elf jaar. Na correctie voor risicofactoren voor hart- en vaatziekten bleek dat patiënten met PMR een significant verhoogd risico hadden op perifere arteriële vaatziekten (hazard ratio 2,50; 95%-BI 1,53 tot 4,08) ten opzichte van patiënten zonder PMR. Er was geen verschil in mortaliteit tussen patiënten met of zonder PMR, noch tussen de PMR-patiënten met of zonder perifere arteriële vaatziekten [Warrington 2009]. In een retrospectief cohortonderzoek (n = 364) werd het effect van behandeling van PMR met glucocorticoïden op het optreden van HVZ onderzocht. De gemiddelde leeftijd was 73 jaar, 67% was vrouw. 85% Van de patiënten kreeg glucocorticoïden. Behandeling met glucocorticoïden gaf geen verhoogd risico op cardiovasculaire ziekten. De hazard ratio voor myocardinfarct, hartfalen, perifere vaatziekten of CVA was respectievelijk 0,59 (95%-BI 0,27 tot 1,27), 0,81 (95%-BI 0,41 tot 1,60), 0,60 (95%-BI 0,23 tot 1,55) en 0,75 (95%-BI 0,37 tot 1,54) [Maradit Kremers 2007]. Conclusie: in een observationeel onderzoek werd een verband gevonden tussen perifeer arterieel vaatlijden en PMR. Er was echter geen verband met mortaliteit. Er werd geen verband gevonden tussen de behandeling van PMR met glucocorticoïden en HVZ.
- Noot 16.↲
Andere manifestaties van reuscelarteriitis In 15% van de gevallen beperkt de vasculitis zich niet tot de arteria temporalis en zijn de arterietakken van de aortaboog betrokken, vooral de arteria subclavia en arteria axillaris. Dit kan leiden tot claudicatio van de arm [Cantini 2008]. Voor het aantonen van een reuscelarteriitis op andere lokalisaties dan de arteria temporalis zijn andere diagnostische modaliteiten, zoals angiografie of MRA, dan de biopsie geschikt.
- Noot 17.↲
Incidentie arteriitis temporalis De incidentie van arteriitis temporalis in Noord-Europa en bij de Angelsaksische bevolking in de VS wordt geschat op 0,2/1.000 bij personen boven de vijftig jaar en is bij vrouwen twee maal zo hoog als bij mannen [Cantini 2004]. Net als PMR komt arteriitis temporalis in Europa vaker voor op hogere breedtegraden en is de prevalentie (zeer) laag in Japan, Azië en Arabische landen. Ongeveer de helft van patiënten met arteriitis temporalis heeft verschijnselen passend bij PMR.
- Noot 18.↲
Visusproblemen bij arteriitis temporalis Arteriitis temporalis kan gepaard gaan met visusklachten. Ongeveer 20% van de patiënten met arteriitis temporalis presenteert zich met visusklachten zoals blindheid, die aanvankelijk eenzijdig en later tweezijdig kan worden, maar ook met tijdelijk (duur enkele seconden (amaurosis fugax) tot enkele uren), soms gedeeltelijk, soms totaal visusverlies van één oog, met verlies van gezichtscherpte of met dubbelzien [Miller 2001]. In patiëntenseries heeft ongeveer 15 tot 20% van de patiënten uiteindelijk blijvend visusverlies [Aiello 1993; Danesh-Meyer 2005; Liozon 2001]. In een retrospectief follow-up onderzoek gedurende vijf jaar (n = 245) bleek de kans op blijvend visusverlies na de start van de behandeling met glucocorticoïden afhankelijk te zijn van het moment van het ontstaan van de visusproblemen. De kans op blijvend visusverlies was 1% als deze ontstond na de start van de behandeling en 13% als deze reeds aanwezig was op het moment dat de behandeling werd gestart [Aiello 1993]. Oculaire beschadigingen treden op afhankelijk van de lokalisatie van de arterie en de mate waarin de arterie is aangetast. Er moet voldoende aantasting zijn om tot ischemie te leiden. Anterieure ischemische optische neuropathie is de meest voorkomende oculaire manifestatie van arteriitis temporalis. Daarnaast kan occlusie van de arteria centralis retinae of posterieure ischemische neuropathie van de nervus opticus optreden [Stone 2007]. Conclusie: door de ernst van de complicaties, de soms snelle progressie en de beperkte mogelijkheid om eenmaal opgetreden visusverlies te behandelen, vereisen nieuw opgetreden visusproblemen bij een vermoeden van arteriitis temporalis een spoedverwijzing.
- Noot 19.↲
Diagnostische criteria voor arteriitis temporalis De relatief lage sensitiviteit van de biopsie (60 tot 80%) in combinatie met het risico op blijvend visusverlies heeft geleid tot het opstellen van diagnostische criteria voor arteriitis temporalis door de American College of Rheumatology (ACR) [Hunder 1990]: een leeftijd boven de vijftig jaar, recent ontstane nieuwe hoofdpijn, afwijkende bevindingen bij onderzoek van de arteria temporalis (pijn bij aanraken, afgenomen pulsatie, niet gerelateerd aan atherosclerose), een BSE > 50mm/uur en biopsie met kenmerkende afwijkingen. In een prospectief cohortonderzoek in de tweede lijn werden 198 patiënten onderzocht vanwege vermoeden van vasculitis [Rao 1998]. De diagnose vasculitis volgens de ACR-criteria werd vergeleken met de uiteindelijke klinische diagnose, die als gouden standaard fungeerde. Vasculitis werd gediagnosticeerd bij 51 patiënten (26%). Bij een prevalentie van 4% was de positief voorspellende waarde van het toepassen van de ACR-criteria voor arteriitis temporalis 29% (95%-BI 19 tot 39). Conclusie: de ACR-criteria voor arteriitis temporalis zijn in de eerste lijn niet goed bruikbaar vanwege de lage prevalentie van arteriitis temporalis. Daarnaast is er een overlap in klinische presentatie tussen de verschillende vasculitiden.
- Noot 20.↲
Biopsie van de arteria temporalis, effect van reeds gestarte behandeling met glucocorticoïden Een biopsie van de arteria temporalis is de beste manier om arteriitis temporalis aan te tonen [Stone 2007]. De sensitiviteit van de biopsie ligt tussen 60 tot 80% wanneer de uiteindelijke klinische diagnose als gouden standaard wordt gezien. Ervaring in het nemen van een biopsie en het niet duidelijk aangetast zijn van de arteria temporalis in het kader van een reuscelarteritis hebben invloed op de uitslag van de biopsie. Om het effect van reeds gestarte behandeling met glucocorticoïden op het biopsieresultaat bij vermoeden van arteriitis temporalis te meten, werd een cohort van 535 opeenvolgende patiënten die een temporalisbiopsie ondergingen (derdelijnscentrum in de VS) bekeken. Ongeveer de helft van de patiënten (n = 249) had tevoren een behandeling met een glucocorticoïd (> 15 mg/dag) gehad, van wie 107 patiënten korter dan één week en 32 patiënten langer dan twee weken. Alle patiënten hadden verschijnselen die op een arteriitis temporalis konden wijzen: 60% had een nieuw ontstane hoofdpijn, 73% had klachten conform de ACR-criteria, 35% had oculaire klachten of symptomen, 75% had een verhoogde BSE (> 40 mm/uur). De gemiddelde leeftijd van de patiënten was 71jaar (spreiding 31 tot 93). Een biopsie werd geclassificeerd als positief (met een onderscheid tussen typisch en atypisch) of negatief. De interbeoordelaarsbetrouwbaarheid van de histologische bevindingen was goed (kappa 0,87). Een biopsie van de contralaterale zijde werd genomen als de aangedane zijde een negatieve biopsie opleverde. 175 patiënten (33%) hadden een positieve biopsie, waarvan 49% typisch. Van de onbehandelde patiënten had 31% een positieve biopsie en van de behandelde patiënten 35%. Conclusie: een biopsie van de arteria temporalis kan tot meer dan veertien dagen na de start van de behandeling met corticosteroïden nog verschijnselen van arteriitis vertonen bij patiënten met aanwijzingen voor arteriitis temporalis [Achkar 1994].
- Noot 21.↲
Hoofdpijn bij arteriitis temporalis In retrospectief dossieronderzoek bij patiënten met aangetoonde arteriitis temporalis bleek geen eenduidig patroon van hoofdpijn voor te komen. Bij ouderen met hoofdpijn, ongeacht soort, lokalisatie, ernst of patroon moet arteriitis temporalis worden overwogen [Solomon 1987].
- Noot 22.↲
Statines en myopathie In een review worden diverse aspecten rond myopathie door statines belicht [Sathasivam 2008]. Het klinisch spectrum van klachten door gebruik van statines is breed: myalgie, myositis, rhabdomyolyse en asymptomatische toename van serum CK. De term myopathie wordt in het algemeen gebruikt om het gehele spectrum van klachten te beschrijven, zoals moeheid, spierpijn, gevoeligheid van de spieren, spierzwakte, nachtelijke krampen en pijn aan de pezen. De spierklachten betreffen meestal de proximale spiergroepen, zijn gegeneraliseerd en verergeren bij inspanning. Wanneer de CK lager blijft dan tien maal de bovengrens van de normaalwaarde spreekt men van myositis. Als de CK meer dan tien maal de bovengrens van de normaalwaarde overschrijdt, spreekt men van rhabdomyolyse. Een licht verhoogde CK komt in de algemene populatie overigens regelmatig voor.
- Noot 23.↲
Anamnese en onderzoek bij arteriitis temporalis In een review werd de waarde van anamnese, lichamelijk onderzoek en de BSE bij patiënten met klinisch vermoeden van arteriitis temporalis bekeken [Smetana 2002]. Er werden 21 onderzoeken gevonden, waarvan 17 retrospectief, waarin patiënten met zowel positieve als negatieve temporalisbiopsie werden geïncludeerd. Anamnese. Van de 2.680 patiënten hadden 1050 patiënten (39%) een positieve temporalisbiopsie. De diagnostische waarde van veertien anamnestische vragen werd onderzocht: anorexie, gewichtsverlies, artralgie, dubbelzien, moeheid, koorts, temporale hoofdpijn, alle hoofdpijnen, pijn bij het kauwen, spierpijn, PMR, eenzijdig visusverlies, alle visuele symptomen, duizeligheid. Alleen pijn bij het kauwen en dubbelzien waren duidelijk geassocieerd met arteriitis temporalis (positieve LR 4,2; 95%-BI 2,8 tot 6,2) respectievelijk 3,4; 95%-BI 1,3 tot 8,6). De sensitiviteit van pijn bij het kauwen bij patiënten met een positieve temporalisbiopsie was slechts 34% (95%-BI 29 tot 41%) en die van dubbelzien 9% (95%-BI 7 tot 13%). Alle overige anamnestische gegevens hadden een lage positieve LR (< 2). De negatieve LR was voor alle vragen niet onderscheidend. Lichamelijk en aanvullend onderzoek. Bevindingen bij lichamelijk onderzoek hadden grotere invloed op de kans om een positieve temporalisbiopsie te vinden dan de anamnese. De diagnostische waarde van de volgende onderzoeksbevindingen werd onderzocht: optische atrofie of optische neuropathie, alle fundusafwijkingen, gevoeligheid van de hoofdhuid, synovitis, kraalvormige structuur (knobbelig aanvoelen) van de arteria temporalis, prominente of vergrote arteria temporalis, gevoelige arteria temporalis, afwezige pulsatie van de arteria temporalis, alle afwijkingen aan de arteria temporalis, mannelijk geslacht, blanke ras, anemie, abnormale BSE, BSE > 50 mm/uur, BSE > 100 mm/uur. Aanwezigheid van synovitis maakte de kans op een positieve temporalisbiopsie minder waarschijnlijk (positieve LR 0,41; 95%-BI 0,23 tot 0,72). Dit gold ook voor de afwezigheid van een afwijking aan de arteria temporalis (negatieve LR 0,53; 95%-BI 0,38 tot 0,75). Alle abnormale bevindingen bij palpatie van de arteria temporalis (kraalvormige structuur van de arteria temporalis, prominente of vergrote arteria temporalis, gevoelige arteria temporalis) maakten de kans op een positieve temporalisbiopsie groter (positieve LR in al deze gevallen > 4). De sensitiviteit van de onderzoeksbevindingen bij een positieve temporalisbiopsie varieerde tussen 30 tot 50% met uitzondering van ‘alle afwijkingen aan de arteria temporalis’ en Kaukasisch ras (een sensitiviteit van respectievelijk 65%; 95%-BI 54% tot 74%, en 86%; 95%-BI 62% tot 97%). Een normale BSE, hoewel niet altijd duidelijk gedefinieerd, maakte de kans op een positieve temporalisbiopsie klein (negatieve LR 0,2; 95%-BI 0,08 tot 0,51). Er werd geen onderzoek gevonden waaruit bleek of de pulsaties van arteria temporalis bij gezonden altijd goed voelbaar zijn. Conclusie: het lijkt waarschijnlijk dat een aantal bevindingen bijdraagt aan de kans op arteriitis temporalis: anamnestisch pijn bij het kauwen, dubbelzien, en afwijkende bevindingen van de arteria temporalis. De kans op arteriitis temporalis is kleiner bij aanwezigheid van een synovitis of een normale BSE.
- Noot 24.↲
Aanvullende diagnostiek Hoewel de differentiaaldiagnose van PMR uitgebreid is (zie noot 8), zal in zijn algemeenheid een gedegen anamnese en lichamelijk onderzoek richting geven aan de noodzaak van aanvullende diagnostiek [Bird 2005]. Uit de literatuur blijken in de praktijk vooral hypothyreoïdie en RA, en ook (hematologische) maligniteiten schuil te gaan achter klachten die aanvankelijk als PMR werden geduid. De werkgroep adviseert daarom in ieder geval een bloedbeeld, TSH, totaal eiwit en een eiwitspectrum als aanvullend laboratoriumonderzoek te doen. Het aanvragen van een aCCP-test of reumafactortest wordt bij vermoeden van RA niet aanbevolen (zie NHG-Standaard Artritis).
- Noot 25.↲
Multipel myeloom, klinische presentatie Het multipel myeloom (ziekte van Kahler) kan gepaard gaan met een verhoogde BSE en botpijn, waardoor het zich kan presenteren als PMR. Het multipel myeloom is een maligne woekering van plasmacellen die uitgaat van het beenmerg. Bij de klinische presentatie staan botpijn (rug) of fracturen na gering trauma of spontaan op de voorgrond. Voorts kunnen er klachten zijn door anemie. Er is meestal een verhoogde infectieneiging. Bij een hoog M-Proteïnegehalte (paraproteïnegehalte) in het serum kan het hyperviscositeitssyndroom ontstaan met neurologische afwijkingen, diffuse slijmvliesbloedingen, visusstoornissen en hartfalen. Verder kunnen klachten ontstaan door een verhoogd calciumgehalte [Van der Meer 2005]. De ziekte van Kahler is zeldzaam en wordt per jaar bij ongeveer 6 nieuwe patiënten per 100.000 inwoners in Nederland gezien. De helft van de patiënten is ouder dan 65 jaar; de ziekte komt even vaak bij vrouwen als bij mannen voor.
- Noot 26.↲
Differentiaal diagnostiek PMR en RA In een prospectief cohortonderzoek in de tweede lijn werden 116 opeenvolgende patiënten met bilaterale pijnklachten gedurende langer dan een maand en een verhoogde BSE gedurende twaalf maanden gevolgd; 19% van de patiënten bleek bij het eerste onderzoek RA te hebben en 81% PMR. Gedurende de follow-up ontwikkelden nog eens negentien patiënten RA. Aan het eind van het onderzoek werd bij 56% van de patiënten uiteindelijk de diagnose PMR bevestigd. BSE, reumafactoren, Hb, bloedbeeld, CD8-lymfocyten, ALAT, ASAT, AF en gGT noch het klinisch beeld konden in een vroeg stadium RA met PMR-achtige klachten onderscheiden van PMR. Alleen de aanwezigheid van perifere synovitis kon daarbij helpen, maar de positief voorspellende waarde hiervan was laag [Caporali 2001].
- Noot 27.↲
Atypische klachten en symptomen bij PMR Atypische manifestaties van PMR komen voor: distale tendinomyogene klachten, zoals carpaletunnelsyndroom als enige symptoom van PMR of pijn aan het distale deel van arm of been, normale bezinking, spierzwakte, asymmetrische pijn en een leeftijd < 50 jaar [Brooks 1997]. Uit een literatuurreview betreffende de associatie van carcinomen met reumatische syndromen bleek dat bij een atypische presentatie een grotere kans bestaat op een onderliggend carcinoom [Naschitz 1997]. Op basis van patiëntenseries en gevalsbeschrijvingen wordt verondersteld dat klachten en symptomen passend bij PMR op een leeftijd < 65 jaar de kans op een alternatieve diagnose groter maken [Bird 1979; Siebert 2001]. Conclusie: atypische manifestaties van PMR, zoals een niet-verhoogde BSE (zie noot 5), asymmetrische klachten en een leeftijd onder vijftig jaar, komen incidenteel voor. Bij deze atypische manifestaties bestaan de nodige valkuilen. Een grotere kans op een alternatieve diagnose lijkt aanwezig. Bij PMR met een normale BSE bestaat enerzijds het risico op overbehandeling van PMR als PMR niet de juiste diagnose blijkt, maar lopen patiënten anderzijds soms ook het risico op onnodig lang uitstel van behandeling als de diagnose PMR wel terecht blijkt.
- Noot 28.↲
Fysiotherapie Er is geen onderzoek gevonden naar de werkzaamheid van fysiotherapie bij de behandeling van PMR. De werkgroep ziet geen meerwaarde in de behandeling van PMR met fysiotherapie.
- Noot 29.↲
Medicamenteuze behandeling van PMR Behandeling met glucocorticoïden is werkzaam bij de behandeling van PMR en arteriitis temporalis. Klinische ervaring en observationele onderzoeken hebben dit aangetoond. In de criteria van Jones en Hazleman en die van Healey is verbetering door glucocorticoïden een van de criteria voor de diagnose. Beide criteria hanteren een startdosis van ? 20 mg prednisolon. Gecontroleerd onderzoek dat prednison of prednisolon met placebo vergelijkt werd niet gevonden. Bij orale toediening met glucocorticoïden heeft geen van deze beschikbare middelen de voorkeur. Prednison zelf is onwerkzaam en wordt in de lever omgezet in de werkzame stof prednisolon. Uit ervaring lijkt een beperkte groep patiënten waarschijnlijk baat te hebben bij behandeling met een NSAID. Onderzoek naar de behandeling van PMR met NSAID’s werd evenwel niet gevonden. Conclusie: er is geen gecontroleerd onderzoek naar de medicamenteuze behandeling van PMR gevonden. Uit klinische ervaring en observationele onderzoeken blijkt dat glucocorticoïden bij PMR werkzaam zijn. Slechts bij een beperkt aantal patiënten kan met een NSAID worden volstaan; het is evenwel niet duidelijk welke patiënten hierbij baat kunnen hebben.
- Noot 30.↲
Afbouwschema glucocorticoïden Er bestaan diverse schema’s voor de afbouw van predniso(lo)n die berusten op klinische ervaring en consensus. Een algemeen geaccepteerd behandelingsschema is er niet. Voor het behandelingsschema baseert de werkgroep zich op een veelgebruikt schema, waarbij de volgende overwegingen een rol hebben gespeeld [Li 2000; Vos 2005]:
- het bereiken van symptoomverlichting met de laagst mogelijke dosering predniso(lo)n;
- een hoge startdosering en een snelle dosisvermindering leiden tot een grotere kans op terugval [Kyle 1989];
- hoge startdoseringen (> 20 mg/dag) geven grotere kans op maskering van andere ziektebeelden die zich op dezelfde wijze presenteren als PMR [Dasgupta 2008];
- afbouwen van glucocorticoïden moet geleidelijk gebeuren in verband met de kleine kans op een cortisoldeficiëntie ten gevolge van chronische suppressie van de hypothalame-hypofysaire-adrenale as;
- gezien de beperkte ervaring van huisartsen met PMR adviseert de werkgroep een vast doseringsschema gedurende de eerste drie maanden van de behandeling. Omdat na de eerste drie maanden het beloop wisselend is, worden voor de periode daarna randvoorwaarden genoemd, waaronder de afbouw adequaat kan geschieden.
- Noot 31.↲
Activering latente tuberculose bij behandeling met glucocorticoïden Een derde deel van de wereldbevolking heeft latente TBC. Een verhoogd risico op latente tuberculose bestaat bij personen met een nauw contact met besmette gevallen en reizen, verblijf of geboorte in gebieden waar TBC veel voorkomt. Verhoogde kans op reactivering van een latente tuberculose bestaat bij verminderde werking van het immuunsysteem door HIV, door jonge of hoge leeftijd, bij chronische ziekten of een slechte voedingstoestand zoals bij daklozen, drugsgebruik of alcoholisme, en bij gebruik van immunosuppressieve middelen. Typische klachten van pulmonaire tuberculose zijn chronische hoest, gewichtsverlies, intermitterende koorts, nachtzweten en bloed ophoesten. Niet-pulmonale tuberculose manifesteert zich afhankelijk van de plek van voorkomen en kan gepaard gaan met gewichtsverlies en intermitterende koorts [Carmona 2006; NICE 2006]. In een casecontroleonderzoek werden cases met TBC geïdentificeerd uit een eerstelijns database (2,7 miljoen patiënten) in Groot-Brittannië gedurende de periode 1990 tot 2001 [Jick 2006]. Iedere case werd gematched met vier controles. Cases en controles met HIV of een hematologische maligniteit werden geëxcludeerd. Er werden 497 nieuwe gevallen van TBC geïdentificeerd. Gebruik van corticosteroïden voorafgaand aan de TBC werd onderscheiden in huidig gebruik (0 tot 120 dagen), recent gebruik (121 tot 180 dagen) en gebruik in het verleden (> 180 dagen geleden). De incidentie in de onderzoekpopulaties was 4,4 per 100.000 en was daarmee gelijk aan de incidentie van de blanke Britse populatie. Bij de cases en controles samen zaten onder andere twaalf patiënten met PMR. De OR voor het risico op TBC was bij huidig gebruik van een corticosteroïd 4,9 (95%-BI 2,9 tot 8,3), voor recent gebruik 4,3 (95%-BI 1,6 tot 11,1) en bij gebruik in het verleden 1,4 (95%-BI 0,9 tot 2,1). Er was een dosisresponsgradiënt: bij huidig gebruik was het verband groter bij een dagdosis > 7,5 mg (OR 7,0; 95%-BI 2,9 tot 16,8) dan bij een dosis < 7,5 mg (OR 2,3; 95%-BI 0,7 tot 7,5). Beperking van het onderzoek is het geringe aantal patiënten met PMR. Conclusie: patiënten die behandeld worden met corticosteroïden hebben een verhoogde kans om TBC te ontwikkelen onafhankelijk van het bestaan van andere risicofactoren. Kwantificering van dit risico hangt daarnaast samen met de prevalentie van TBC, omgevingsfactoren en risicofactoren van de patiënt.
- Noot 32.↲
Bijnierschorsinsufficiëntie Langdurig gebruik van glucocorticoïden kan leiden tot een verminderde functie van de bijnierschors. Dit wordt ook wel een tertiaire bijnierschorsinsufficiëntie genoemd. In stresssituaties zoals een (koortsende) ziekte, ongeval of operatie, of ernstige psychische stress, waarbij aanmaak van meer bijnierschorshormoon cortisol dan normaal nodig is, kunnen de al falende bijnieren geen gehoor geven aan deze verhoogde behoefte en kan een acute bijnierschorsinsufficiëntie ontstaan. Ook het abrupt staken van glucocorticoïden, wanneer dit langer dan drie weken werd gebruikt, kan leiden tot een (acute) bijnierschorsinsufficiëntie. Een geleidelijke vermindering van de dosering geeft de bijnier de tijd om naar een normaal patroon van hormoonsecretie terug te keren. Vermindering van de dosering van glucocorticoïden kan echter ook met onthoudingsverschijnselen gepaard gaan, waarbij er klachten optreden gelijkend op die van bijnierschorsinsufficiëntie terwijl de cortisolspiegels acceptabel zijn. Dit kan behandeld worden met een tijdelijke verhoging van de dosering glucocorticoïden. De meeste klinische verschijnselen van bijnierschorsinsufficiëntie zijn aspecifiek. Ze ontstaan vaak geleidelijk in de loop der maanden, soms kunnen ze echter snel ontstaan [Mulder 2008]. Frequente verschijnselen van bijnierschorsinsufficiëntie zijn (ernstige) moeheid en (spier)zwakte, anorexia, gewichtsverlies, misselijkheid, braken, buikpijn, diarree, duizeligheid, (orthostatische) hypotensie, het optreden van spontane hypoglykemieën en psychische symptomen (onder andere depressie). Soms kan een levensbedreigende situatie ontstaan met hypotensie en shock (een hypocortisolistische crise). Het is niet bekend hoe lang en welke dosering glucocorticoïden gebruikt moet zijn om de kans op een acute bijnierinsufficiëntie te vergroten. De duur en de ernst van de suppressie van de hypofyse-bijnieras ten gevolge van gebruik van (farmacologische doseringen) glucocorticoïden zijn individueel zeer variabel. Als praktische richtlijn wordt vaak aangehouden dat wanneer langer dan drie weken farmacologische doseringen glucocorticoïden (> 7,5 mg prednis(ol)on per dag) gegeven zijn, een klinisch relevante suppressie van de hypofyse-bijnieras mogelijk is. Dit kan aanhouden tot een jaar na beëindiging van de glucocorticoïdtoediening [Hermus 1998]. In de literatuur bestaat geen eenduidigheid over de mate van dosisaanpassing bij ziekte. Klachten passend bij bijnierschorsinsufficiëntie kunnen in het algemeen worden voorkómen door bij (koortsende) ziekte de glucocorticoïddosering te verdubbelen (gedurende de hele periode van koorts). Niet duidelijk is of dit in de eerste lijn in alle gevallen van ziekte daadwerkelijk noodzakelijk is. Onderzoek naar de mate waarin dit probleem zich in de eerste lijn voordoet werd niet gevonden.
- Noot 33.↲
Glucocorticoïden en complicaties In een meta-analyse (n = 6.602) werd onderzocht of behandeling met glucocorticoïden, ongeacht de duur of dosering, in vergelijking met placebo een verhoogde kans gaf op complicaties zoals een peptisch ulcus, dermatologische effecten (onder andere acne, hirsutisme, Cushing uiterlijk), sepsis, diabetes, hypertensie, osteoporose en tuberculose en delier. Dermatologische effecten (OR 4,5; 95%-BI 3,5 tot 5,7), diabetes (OR 1,7; 95%-BI 1,1 tot 2,6) en hypertensie (OR 2,2; 95%-BI 1,4 tot 3,8) werden statistisch significant vaker aangetroffen in de behandelgroep met glucocorticoïden dan in de placebogroep. Een peptisch ulcus (OR 1,2; 95%-BI 0,8 tot 2,0), sepsis, osteoporose (OR 1,7; 95%-BI 0,7 tot 4,1), psychose (delier) en tuberculose kwamen vaker voor in de corticosteroïdgroep, maar de verschillen met de placebogroep waren statistisch niet significant. Geconcludeerd werd dat een ulcus geen contra-indicatie is voor een behandeling met corticosteroïden [Conn 1994]. In het HARM-onderzoek, een prospectieve multicenterstudie, werd de frequentie van geneesmiddelgerelateerde ziekenhuisopnames in Nederland onderzocht [Leendertse 2008]. Patiënten ouder dan 65 jaar hadden een tweemaal zo hoge frequentie van geneesmiddelgerelateerde opnames ten opzichte van patiënten jonger dan 65 jaar. Gastro-intestinale bloedingen, cardiovasculaire problemen, respiratoire aandoeningen, andere gastro-intestinale klachten en ontregelde diabetes mellitus waren de meest gevonden oorzaak van geneesmiddelgerelateerde opnames. De geneesmiddelen die de meeste problemen veroorzaakten waren trombocytenaggregatieremmers, coumarines, NSAID’s, psycholeptica, antidiabetica en glucocorticoïden. Therapieontrouw, verminderde cognitie, verminderde nierfunctie, het niet- zelfstandig wonen, meerdere aandoeningen in de medische voorgeschiedenis en polyfarmacie zijn geïdentificeerd als de belangrijkste onafhankelijke risicofactoren. Conclusie: dermatologische effecten, diabetes en hypertensie komen vaker voor bij behandeling met glucocorticoïden.
- Noot 34.↲
Monitoren van PMR Voor het monitoren van PMR gebruikt men in het algemeen de klinische symptomen gecombineerd met de BSE en/of CRP. Bij de meeste patiënten is de BSE een goede maat voor de activiteit van de ziekte. De BSE kan echter normaal zijn bij ziekteactiviteit en afwijkend bij afwezigheid daarvan. De klachten en symptomen van patiënten zijn doorgaans een meer betrouwbare maat voor de ziekteactiviteit dan laboratoriumonderzoek. Leeb en Bird hebben een scoresysteem ontwikkeld om de activiteit van PMR vast te kunnen stellen [Leeb 2004]. Hiermee zou de corticosteroïddosering bij het afbouwen beter kunnen worden afgestemd op de behoefte van de patiënt. Dit scoresysteem bestaat uit vijf variabelen: ochtendstijfheid (in minuten), vermogen om arm te heffen (op een schaal 0 tot 3), globale inschatting van de ernst van de ziekte (visueel analoge schaal 0 tot 10), CRP en pijn (visueel analoge schaal 0 tot 10). In een vignettenonderzoek in de eerste lijn bleek dat het met dit scoresysteem niet goed mogelijk is om in te schatten of een patiënt met een lagere dosering zou kunnen volstaan [Binard 2007].
- Noot 35.↲
Effect van glucocorticoïden op klachten, bijwerkingen In een prospectief observationeel onderzoek (n = 129) in de tweede lijn in Engeland werden patiënten met PMR (spierpijn schouder- en/of heupgordel, in afwezigheid van spierzwakte, ochtendstijf > 30 minuten, BSE > 30 mm/uur, afwezigheid van ziekte met eenzelfde presentatie) gevolgd [Hutchings 2007]. Uitkomstmaten waren: verbetering door corticosteroïden (startdosering 15 mg/dag) na drie weken, terugval, meting van de QoL middels de SF-36 (minimaal klinisch relevant verschil is vijf punten), de Health Assessment Questionnaire, en overeenstemming onder reumatologen over een eventuele herziening van de diagnose na één jaar. Complete respons was als volgt gedefinieerd: geen klachten of ten minste 50% reductie in pijn in schouder- en heupgordel op een VAS, ochtendstijfheid < 30min, BSE < 30 mm/uur en CRP < 10 mg/dl. De gemiddelde leeftijd was 70,9 jaar (52 tot 92 jaar), 60% was vrouw, 2,3% niet-blank. De gemiddelde duur van de klachten vóór presentatie was drie maanden. Een derde had perifere symptomen (hand/polspijn, oedeem of gewrichtsklachten). Na drie weken had ongeveer een derde nog een verhoogde BSE, 29% ochtendstijfheid > 30 min en een kwart proximale pijnklachten. Ruim de helft (55%) had geen complete respons in drie weken. 60% van de terugval trad op binnen twee weken na reductie van de dosis. Zowel de fysieke als mentale component van de SF-36 was met 12,6 (95%-BI 10,8 tot 14,4) respectievelijk 11,2 (95%-BI 8,5 tot 13,8) punten verbeterd na één jaar. Proximale pijn en ochtendstijfheid waren significant geassocieerd met een lagere fysieke kwaliteit van leven. Bijwerkingen van de behandeling waren: fracturen (5%), vollemaansgezicht (29%), enkeloedeem (21%), slechte glucoseregulatie (12%), bloeduitstortingen (20%), dyspepsie (39%), hypertensie (25%), kortademigheid (23%), gewichtstoename (> 5% toename gewicht in twaalf maanden) (44%). Prednis(ol)on kan, vanwege zijn enigszins aldosteronachtige werking, resulteren in een daling van de kaliumconcentratie, meestal nog binnen het normale gebied, soms leidend tot een hypokaliëmie. De kans hierop is met name verhoogd als een diureticum wordt gebruikt. Er is geen goed onderzoek gevonden naar verschillen in beloop tussen mannen en vrouwen bij behandeling en naar het verschil tussen mannen en vrouwen in het voorkomen van bijwerkingen. Conclusie: de complete verbetering door glucocorticoïden kan soms enkele weken duren. Bij de follow-up is vooral de afname van de proximale pijn en ochtendstijfheid belangrijk, omdat patiënten deze als zeer hinderlijk ervaren. Langdurig gebruik van glucocorticoïden kan, zoals bekend, ernstige bijwerkingen hebben [Hutchings 2007].
- Noot 36.↲
Terugval bij behandeling met glucocorticoïden In een prospectief observationeel onderzoek (n = 74, follow-up zestig weken) werd het klinisch beloop van PMR (n = 39) (criteria volgens Jones en Hazleman) en arteriitis temporalis (n = 18) of een combinatie van beide (n = 17) gedurende de eerste twee maanden na het stellen van de diagnose en tijdens de behandeling onderzocht [Kyle 1993]. Drie patiënten vielen uit, van wie één persoon door overlijden aan de gevolgen van arteriitis temporalis. Een terugval bij PMR werd gedefinieerd als klachten die een verhoging van de corticosteroïddosering noodzakelijk maakten, waarbij minstens pijn en stijfheid in de schouder- of heupgordel aanwezig waren. Een terugval werd bij arteriitis temporalis gedefinieerd als hoofdpijn met gevoeligheid van de arteria temporalis of aanwezigheid van visuele klachten. Patiënten met arteriitis temporalis kregen gedurende vijf dagen 40 mg prednisolon en werden daarna gerandomiseerd in een groep met een hoge dosis (vier weken 40 mg, twee weken 30 mg, twee weken 20 mg) en een groep met een lage dosis (vier weken 20 mg, twee weken 15 mg, twee weken 10 mg). Patiënten met PMR werden at random ingedeeld in een groep met hoge dosis regime (prednisolon vier weken 20 mg, twee weken 15 mg, twee weken 10 mg) of een groep met een lage dosis (vier weken 10 mg, twee weken 7,5 mg, twee weken 5 mg). De glucocorticoïden werden afgebouwd met 2,5 mg/maand in twee tot vier maanden, daarna met ongeveer 1 mg/maand in vier tot twaalf maanden en daarna met 1 mg iedere twee tot drie maanden. Zes patiënten met PMR ontwikkelden gedurende de eerste twee maanden van behandeling arteriitis temporalis en twee patiënten in de periode daarna. Vier patiënten met arteriitis temporalis ontwikkelden PMR 15 tot 75 weken na de start van de behandeling. In de eerste twee maanden van behandeling werd 77 keer een terugval door de arts geobserveerd, 24 keer bij PMR, acht keer bij arteriitis temporalis en elf keer bij patiënten met PMR/arteriitis temporalis. Er werd 41 keer een terugval gemeld door de patiënt. In slechts 27% van de gevallen werd geen terugval gezien of gemeld na twee maanden behandeling. Driekwart van de patiënten hadden één tot twee maal een terugval. In een ander observationeel prospectief onderzoek bij 94 opeenvolgende patiënten met PMR in een tweedelijns setting werd het optreden van terugval gedurende 39 maanden bekeken wanneer patiënten werden behandeld met corticosteroïden [Salvarani 2005]. Klinische symptomen, BSE en CRP werden gemeten. De BSE was verhoogd bij 91,5% van de patiënten voor de start van de therapie; de CRP was verhoogd bij 98,9%. De helft van de patiënten had ten minste één terugval en een kwart ten minste twee terugvalperiodes. Na vier weken therapie was bij 13% van de patiënten de BSE nog verhoogd en de CRP bij 41%. In het eerste jaar van de follow-up bleef bij 9% van de patiënten de CRP verhoogd, terwijl geen enkele patiënt een verhoogde BSE had. Een persisterend verhoogde CRP gaf een verhoogd risico op een terugval. Hogere startdosering en snelle dosisvermindering werd ook in een ander cohortonderzoek aangemerkt als risicofactor voor terugval [Maradit Kremers 2005]. Het beloop en de duur van de behandeling van PMR werd in vier huisartsenpraktijken in Nederland retrospectief onderzocht in de periode 1985 tot 1997. PMR werd bij 49 patiënten vastgesteld (40 vrouwen, 9 mannen). Patiënten werden gemiddeld 2,2 jaar (3 tot 89 maanden) met prednison behandeld; de initiële dosis bedroeg gemiddeld 20,5 mg. Bij 42 patiënten stelde de huisarts zelf de diagnose en startte de therapie. In twee gevallen kon worden volstaan met een NSAID. Een terugval deed zich bij 33 patiënten voor, waarbij het gemiddeld vier maanden duurde voor de eerste exacerbatie optrad. Bij zeven vrouwen en één man traden recidieven op. Gemiddeld waren deze patiënten 9,5 maanden gestopt met medicatie [Prickarts 1999]. Conclusie: een tijdelijk terugval bij de behandeling met glucocorticoïden komt bij ten minste de helft van de patiënten ten minste eenmaal voor. Een persisterend verhoogde CRP en snelle afbouw bij een hoge startdosering verhogen de kans op terugval.
- Noot 37.↲
Toevoeging van methotrexaat aan glucocorticoïden Behandeling met glucocorticoïden kan gepaard gaan met ernstige bijwerkingen. Soms zijn er contra-indicaties voor het langdurig gebruik van glucocorticoïden, zoals ernstige osteoporose. Van der Veen et al. onderzochten in een dubbelblind placebogecontroleerd onderzoek (n = 40; van wie zes verschijnselen van arteriitis temporalis hadden) of toevoeging van methotrexaat (MTX) 7,5 mg/week aan prednison (startdosering 20 mg/dag) een steroïdsparend effect had bij de behandeling van PMR. De uitval was hoog (19/40) Na twee jaar follow-up bleek MTX geen steroïdsparend effect te hebben [Van der Veen 1996]. In een gerandomiseerde prospectief onderzoek werden patiënten (n = 42) gedurende één jaar gevolgd. Patiënten kregen óf MTX wekelijks in combinatie met prednison óf monotherapie met prednison. Na zes maanden werd getracht de prednison af te bouwen. Na twaalf maanden waren alle patiënten in remissie. Patiënten die behandeld waren volgens het MTX-regime hadden minder prednison nodig om in remissie te blijven. Daarnaast was de botdichtheid in de prednison-arm significant verlaagd [Ferraccioli 1996]. In een dubbelblind placebogecontroleerd onderzoek bij 72 patiënten met PMR werd de effectiviteit en veiligheid van toevoeging van methotrexaat aan een behandeling met glucocorticoïden bekeken. Daaruit bleek dat bij een initiële behandeling met prednison 25 mg/dag plus methotrexaat 10 mg/week meer patiënten na 76 weken geen prednison meer gebruikten dan in de groep met prednison 25 mg/dag plus placebo (87% versus 53% patiënten). Een terugval of een recidief van de klachten na staken was lager in de methotrexaatgroep dan in de placebogroep (27 episodes versus 50 episodes). Het aantal patiënten dat bijwerkingen ontwikkelde was in beide groepen gelijk, het type bijwerking was verschillend. In de methotrexaatgroep kwamen meer gastro-intestinale bijwerkingen voor. Eén patiënt in de methotrexaatgroep ontwikkelde melaena. Er was geen verschil in corticosteroïdgerelateerde bijwerkingen in beide groepen [Caporali 2004]. In 2009 werd door een internationaal breed panel van reumatologen aanbevelingen gedaan voor gebruik van methotrexaat bij reumatische aandoeningen, met name bij reumatoïde artritis. Methotrexaat werd als steroïdsparend medicament bij PMR en arteriitis temporalis aanbevolen [Visser 2009]. Overwegingen: gezien de potentieel ernstige bijwerkingen van methotrexaat en de intensievere follow-up is er een beperkte plaats voor dit middel, te meer omdat PMR voorkomt op een leeftijd waarop comorbiditeit vaak voorkomt. Bij ernstige bijwerkingen of contra-indicaties voor langdurig gebruik van glucocorticoïden is MTX te overwegen. Het gebruik van MTX is een veilig middel in de handen van artsen die hier ervaring mee hebben en de geldende richtlijn volgen [Verduijn 2009]. Behandeling met MTX dient daarom in de tweede lijn plaats te vinden. Conclusie: er is beperkt bewijs dat toevoeging van 10 mg methotrexaat per week aan een behandeling met prednisolon gedurende ten minste een jaar bij PMR kan resulteren in een kortere gebruiksperiode van prednisolon en minder terugval of recidief van de klachten.
Literatuur
- 1.Bij verwijzingen naar NHG-producten: zie www.nhg.org.
- 2.Achkar AA, Lie JT, Hunder GG, O'Fallon WM, Gabriel SE. How does previous corticosteroid treatment affect the biopsy findings in giant cell (temporal) arteritis? Ann Intern Med 1994;120:987-92.
- 3.Aiello PD, Trautmann JC, McPhee TJ, Kunselman AR, Hunder GG. Visual prognosis in giant cell arteritis. Ophthalmology 1993;100:550-5.
- 4.Bagratuni L. Anarthritic rheumatoid disease. Lancet 1956;271:694-7.
- 5.Bagratuni L. Prognosis in the anarthritic rheumatoid syndrome. Br Med J 1963;1:513-8.
- 6.Bahlas S, Ramos-Remus C, Davis P. Utilisation and costs of investigations, and accuracy of diagnosis of polymyalgia rheumatica by family physicians. Clin Rheumatol 2000;19:278-80.
- 7.Barber HS. Myalgic syndrome with constitutional effects; polymyalgia rheumatica. Ann Rheum Dis 1957;16:230-7.
- 8.Barraclough K, Liddell WG, Du Toit J, Foy C, Dasgupta B, Thomas M, et al. Polymyalgia rheumatica in primary care: a cohort study of the diagnostic criteria and outcome. Fam Pract 2008;25:328-33.
- 9.Binard A, De Bandt M, Berthelot JM, Saraux A. Usefulness of the disease activity scores for polymyalgia rheumatica for predicting glucocorticoid dose changes: a study of 243 scenarios. Arthritis Rheum 2007;57:481-6.
- 10.Bird HA, Esselinckx W, Dixon AS, Mowat AG, Wood PH. An evaluation of criteria for polymyalgia rheumatica. Ann Rheum Dis 1979;38:434-9.
- 11.Bird HA, Leeb BF, Montecucco CM, Misiuniene N, Nesher G, Pai S, et al. A comparison of the sensitivity of diagnostic criteria for polymyalgia rheumatica. Ann Rheum Dis 2005;64:626-9.
- 12.Brooks RC, McGee SR. Diagnostic dilemmas in polymyalgia rheumatica. Arch Intern Med 1997;157:162-8.
- 13.Cantini F, Salvarani C, Olivieri I. Erythrocyte sedimentation rate and C-reactive protein in the diagnosis of polymyalgia rheumatica. Ann Intern Med 1998;128:873-4.
- 14.Cantini F, Salvarani C, Olivieri I, Macchioni L, Ranzi A, Niccoli L, et al. Erythrocyte sedimentation rate and C-reactive protein in the evaluation of disease activity and severity in polymyalgia rheumatica: a prospective follow-up study. Semin Arthritis Rheum 2000;30:17-24.
- 15.Cantini F, Niccoli L, Storri L, Nannini C, Olivieri I, Padula A, et al. Are polymyalgia rheumatica and giant cell arteritis the same disease? Semin Arthritis Rheum 2004;33:294-301.
- 16.Cantini F, Niccoli L, Nannini C, Bertoni M, Salvarani C. Diagnosis and treatment of giant cell arteritis. Drugs Aging 2008;25:281-97.
- 17.Caporali R, Montecucco C, Epis O, Bobbio-Pallavicini F, Maio T, Cimmino MA. Presenting features of polymyalgia rheumatica (PMR) and rheumatoid arthritis with PMR-like onset: a prospective study. Ann Rheum Dis 2001;60:1021-4.
- 18.Caporali R, Cimmino MA, Ferraccioli G, Gerli R, Klersy C, Salvarani C, et al. Prednisone plus methotrexate for polymyalgia rheumatica: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 2004;141:493-500.
- 19.Carmona L. Quantifying risks: the case between glucocorticoids and tuberculosis. Arthritis Rheum 2006;55:1-2.
- 20.Ceccato F, Roverano SG, Papasidero S, Barrionuevo A, Rillo OL, Paira SO. Peripheral musculoskeletal manifestations in polymyalgia rheumatica. J Clin Rheumatol 2006;12:167-71.
- 21.Chuang TY, Hunder GG, Ilstrup DM, Kurland LT. Polymyalgia rheumatica: a 10-year epidemiologic and clinical study. Ann Intern Med 1982;97:672-80.
- 22.Cimmino MA, Zaccaria A. Epidemiology of polymyalgia rheumatica. Clin Exp Rheumatol 2000;18:S9-11.
- 23.Conn HO, Poynard T. Corticosteroids and peptic ulcer: meta-analysis of adverse events during steroid therapy. J Intern Med 1994;236:619-32.
- 24.Danesh-Meyer H, Savino PJ, Gamble GG. Poor prognosis of visual outcome after visual loss from giant cell arteritis. Ophthalmology 2005;112:1098-103.
- 25.Dasgupta B, Salvarani C, Schirmer M, Crowson CS, Maradit-Kremers H, Hutchings A et al. Developing classification criteria for polymyalgia rheumatica: comparison of views from an expert panel and wider survey. J Rheumatol 2008;35:270-7.
- 26.Ferraccioli G, Salaffi F, De Vita S., Casatta L, Bartoli E. Methotrexate in polymyalgia rheumatica: preliminary results of an open, randomized study. J Rheumatol 1996;23:624-8.
- 27.Gonzalez-Gay MA, Garcia-Porrua C, Salvarani C, Olivieri I, Hunder GG. The spectrum of conditions mimicking polymyalgia rheumatica in Northwestern Spain. J Rheumatol 2000;27:2179-84.
- 28.Goodwin JS. The very low prevalence of polymyalgia rheumatica in blacks may be an artifact. J Am Geriatr Soc 1990;38:824-6.
- 29.Healey LA. Long-term follow-up of polymyalgia rheumatica: evidence for synovitis. Semin Arthritis Rheum 1984;13:322-8.
- 30.Hermus AR, Zelissen PM. Diagnostiek en therapie bij patienten met bijnierschorsinsufficientie. Ned Tijdschr Geneeskd 1998;142:944-9.
- 31.Hunder GG, Arend WP, Bloch DA, Calabrese LH, Fauci AS, Fries JF, et al. The American College of Rheumatology 1990 criteria for the classification of vasculitis. Introduction. Arthritis Rheum 1990;33:1065-7.
- 32.Hutchings A, Hollywood J, Lamping DL, Pease CT, Chakravarty K, Silverman B, et al. Clinical outcomes, quality of life, and diagnostic uncertainty in the first year of polymyalgia rheumatica. Arthritis Rheum 2007;57:803-9.
- 33.Jick SS, Lieberman ES, Rahman MU, Choi HK. Glucocorticoid use, other associated factors, and the risk of tuberculosis. Arthritis Rheum 2006;55:19-26.
- 34.Jones JG, Hazleman BL. Prognosis and management of polymyalgia rheumatica. Ann Rheum Dis 1981;40:1-5.
- 35.Kyle V, Hazleman BL. Treatment of polymyalgia rheumatica and giant cell arteritis. I. Steroid regimens in the first two months. Ann Rheum Dis 1989;48:658-61.
- 36.Kyle V, Hazleman BL. The clinical and laboratory course of polymyalgia rheumatica/giant cell arteritis after the first two months of treatment. Ann Rheum Dis 1993;52:847-50.
- 37.Leeb BF, Bird HA. A disease activity score for polymyalgia rheumatica. Ann Rheum Dis 2004;63:1279-83.
- 38.Leendertse AJ, Egberts AC, Stoker LJ, Van den Bemt PM. Frequency of and risk factors for preventable medication-related hospital admissions in the Netherlands. Arch Intern Med 2008;168:1890-6.
- 39.Li C, Dasgupta B. Corticosteroids in polymyalgia rheumatica--a review of different treatment schedules. Clin Exp Rheumatol 2000;18:S56-S57.
- 40.Liozon E, Herrmann F, Ly K, Robert PY, Loustaud V, Soria P, et al. Risk factors for visual loss in giant cell (temporal) arteritis: a prospective study of 174 patients. Am J Med 2001;111:211-7.
- 41.Maradit Kremers H, Reinalda MS, Crowson CS, Zinsmeister AR, Hunder GG, Gabriel SE. Relapse in a population based cohort of patients with polymyalgia rheumatica. J Rheumatol 2005;32:65-73.
- 42.Maradit Kremers H, Reinalda MS, Crowson CS, Davis JM, III, Hunder GG, Gabriel SE. Glucocorticoids and cardiovascular and cerebrovascular events in polymyalgia rheumatica. Arthritis Rheum 2007;57:279-86.
- 43.Martinez-Taboada VM, Blanco R, Rodriguez-Valverde V. Polymyalgia rheumatica with normal erythrocyte sedimentation rate: clinical aspects. Clin Exp Rheumatol 2000;18:S34-S37.
- 44.Miller NR. Visual manifestations of temporal arteritis. Rheum Dis Clin North Am 2001;27:781-97, vi.
- 45.Mulder AH, Nauta S, Pieters GF, Hermus AR. Addison-crisis bij patienten bekend wegens bijnierschorsinsufficientie: het belang van vroegtijdig ingrijpen. Ned Tijdschr Geneeskd 2008;152:1497-500.
- 46.Myklebust G, Gran JT. A prospective study of 287 patients with polymyalgia rheumatica and temporal arteritis: clinical and laboratory manifestations at onset of disease and at the time of diagnosis. Br J Rheumatol 1996;35:1161-8.
- 47.Naschitz JE, Slobodin G, Yeshurun D, Rozenbaum M, Rosner I. Atypical polymyalgia rheumatica as a presentation of metastatic cancer. Arch Intern Med 1997;157:2381.
- 48.NICE. Tuberculosis: clinical diagnosis and management of tuberculosis, and measures for its prevention and control (2006). Royal College of Physicians. www.nice.org.uk/Guidance/CG33. Geraadpleegd mei 2009.
- 49.Pavlica P, Barozzi L, Salvarani C, Cantini F, Olivieri I. Magnetic resonance imaging in the diagnosis of PMR. Clin Exp Rheumatol 2000;18:S38-S39.
- 50.Prickarts M, Lagro-Janssen T. Polymyalgia rheumatica in vier huisartspraktijken. Huisarts Wet 1999;42:597-601.
- 51.Rao JK, Allen NB, Pincus T. Limitations of the 1990 American College of Rheumatology classification criteria in the diagnosis of vasculitis. Ann Intern Med 1998;129:345-52.
- 52.Salvarani C, Cantini F, Macchioni P, Olivieri I, Niccoli L, Padula A, et al. Distal musculoskeletal manifestations in polymyalgia rheumatica: a prospective followup study. Arthritis Rheum 1998;41:1221-6.
- 53.Salvarani C, Cantini F, Niccoli L, Macchioni P, Consonni D, Bajocchi G, et al. Acute-phase reactants and the risk of relapse/recurrence in polymyalgia rheumatica: a prospective followup study. Arthritis Rheum 2005;53:33-8.
- 54.Sathasivam S, Lecky B. Statin induced myopathy. BMJ 2008;337:a2286.
- 55.Siebert S, Lawson TM, Wheeler MH, Martin JC, Williams BD. Polymyalgia rheumatica: pitfalls in diagnosis. J R Soc Med 2001;94:242-4.
- 56.Smeeth L, Cook C, Hall AJ. Incidence of diagnosed polymyalgia rheumatica and temporal arteritis in the United Kingdom, 1990-2001. Ann Rheum Dis 2006;65:1093-8.
- 57.Smetana GW, Shmerling RH. Does this patient have temporal arteritis? JAMA 2002;287:92-101.
- 58.Solomon S, Cappa KG. The headache of temporal arteritis. J Am Geriatr Soc 1987;35:163-5.
- 59.Stone JH. Vasculitis: a collection of pearls and myths. Rheum Dis Clin North Am 2007;33:691-739, v.
- 60.Van de Lisdonk EH, Van den Bosch WJHM, Lagro-Janssen ALM. Ziekten in de huisartspraktijk. 5 editie. Maarssen: Elsevier Gezondheidszorg, 2008.
- 61.Van der Meer J, Stehouwer CDA. Interne geneeskunde. 13 editie. Houten: Bohn Stafleu van Loghum, 2005.
- 62.Van der Veen MJ, Dinant HJ, Van Booma-Frankfort C, Van Albada-Kuipers GA, Bijlsma JW. Can methotrexate be used as a steroid sparing agent in the treatment of polymyalgia rheumatica and giant cell arteritis? Ann Rheum Dis 1996;55:218-23.
- 63.Verduijn MM, Van den Bemt BJF, Dijkmans BAC, Van der Waal RIF, Horikx A. Methotrexaat veilig, mits juist voorgeschreven. Ned Tijdschr Geneesk 2009;153:A695.
- 64.Visser K, Katchamart W, Loza E, Martinez-Lopez JA, Salliot C, Trudeau J, et al. Multinational evidence-based recommendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis: integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E Initiative. Ann Rheum Dis 2009;68:1086-93.
- 65.Vos PAJM, Bijlsma JWJ, Derksen RHWM. Polymyalgia rheumatica en arteriitis temporalis. Ned Tijdschr Geneeskd 2005;149:1932-7.
- 66.Warrington KJ, Jarpa EP, Crowson CS, Cooper LT, Hunder GG, Matteson EL, et al. Increased risk of peripheral arterial disease in polymyalgia rheumatica: a population-based cohort study. Arthritis Res Ther 2009;11:R50.
Reacties
Er zijn nog geen reacties.