-
De rol van de huisarts in verschillende fasen van het zorgproces (bij verwijzing naar de mammapoli, het aanbieden van een vervolgcontact na de diagnose en in de nazorg) is toegevoegd.
-
Het beleid bij familiaire belasting (indicaties voor screening buiten het bevolkingsonderzoek en voor verwijzing naar een klinisch geneticus) is herzien en weergegeven in [stroomdiagram 2].
-
Vrouwen met een uitslag BI-RADS 0 (onvolledig onderzoek) in het bevolkingsonderzoek borstkanker worden vanaf 1 juli 2017 verwezen naar een afdeling radiologie van een ziekenhuis waar ook een mammapoli is (was: naar de mammapoli).
-
Postmenopauzale vrouwen met tepeluitvloed (ongeacht de kleur) worden naar de mammapoli verwezen (was: geen reden voor mammogram of verwijzen bij melkachtige of heldere tepeluitvloed).
-
Bij vrouwen in de leeftijdsgroep 50 tot 75 jaar worden zeven van de tien gevallen van borstkanker gevonden via het bevolkingsonderzoek borstkanker; drie van de tien gevallen worden door de patiënt zelf tussen twee screeningsrondes door opgemerkt.
-
Bij vrouwen met nieuwe, gelokaliseerde klachten is een recent niet-afwijkend mammogram geen reden om van de richtlijnen diagnostiek en beleid af te wijken.
-
Bij vrouwen van 30 jaar en ouder is het mammogram het beeldvormend onderzoek van eerste keus. Bij vrouwen die jonger zijn dan 30 jaar, zwanger zijn of borstvoeding geven heeft echografie de voorkeur boven een mammogram.
-
Een niet-afwijkend mammo- of echogram sluit een maligniteit niet met zekerheid uit. Verwijs daarom naar een mammapoli indien drie maanden na een niet-afwijkend mammo- of echogram nog steeds sprake is van een knobbeltje of gelokaliseerde pijn in één borst.
-
Op basis van de familieanamnese kan er een indicatie bestaan voor screening buiten het bevolkingsonderzoek of verwijzing naar een klinisch geneticus (zie [stroomdiagram 2]). Vrouwen met een indicatie voor screening buiten het bevolkingsonderzoek komen van hun 40e tot 50e levensjaar in aanmerking voor een jaarlijks mammogram via de huisarts; van 50 tot 75 jaar kunnen zij participeren in het bevolkingsonderzoek. Vrouwen met een indicatie voor verwijzing naar de klinisch geneticus ontvangen daar indien nodig een screeningsadvies.
-
Vrouwen ouder dan 60 jaar die ten minste vijf jaar geleden borstsparend behandeld zijn voor borstkanker kunnen doorgaans door de behandelend specialist voor de nacontroles naar de huisarts worden terugverwezen.
Inbreng van de patiënt
Afweging door de huisarts
Delegeren van taken
Inleiding
-
de diagnostiek bij vrouwen die de huisarts bezoeken met klachten van de borst(en);
-
het beleid bij klachten van de borst(en);
-
de rol van de huisarts bij verwijzing naar de mammapoli;
-
de follow-up na de behandeling voor borstkanker;
-
het beleid bij familiaire belasting: indicaties voor screening en verwijzing naar een klinisch geneticus;
-
de rol van de huisarts bij het bevolkingsonderzoek naar borstkanker.
Achtergronden
Epidemiologie
Kans op borstkanker bij klachten
Risicofactoren
-
een verhoogd risico op borstkanker op basis van de familieanamnese;
-
dragerschap van een BRCA1- of BRCA2-mutatie (of 50% kans hierop) of mutaties in andere risicogenen, zoals CHEK2, en in zeldzamere gevallen PTEN, TP53 en NF1 (NB: al deze genmutaties kunnen ook overerven via de mannelijke lijn);7,8
-
invasief borstkanker in de voorgeschiedenis;
-
DCIS in de voorgeschiedenis;
-
thoraxbestraling voor het 40e levensjaar in de voorgeschiedenis, bijvoorbeeld voor hodgkinlymfoom.9
Pathologie en pathofysiologie
Behandelingsmogelijkheden tweede lijn
Richtlijnen diagnostiek bij klachten van de borst(en)
Anamnese
-
de aard van de klacht of afwijking (pijn, knobbeltje of tepeluitvloed) en de lokalisatie;
-
het tijdstip van ontdekking, invloed van de cyclus;
-
de voorgeschiedenis van borstklachten of borstkanker;
-
een eventuele thoraxbestraling (bijvoorbeeld voor hodgkinlymfoom);
-
de familiaire belasting: het voorkomen van borst-, eierstok-, eileider- en prostaatkanker bij eerste- en tweedegraads familieleden aan zowel maternale als paternale zijde, leeftijd ten tijde van diagnose en eventueel bilateraal of multifocaal karakter van de borstkanker (voor interpretatie en beleid zie Familiaire belasting: indicaties voor screening en verwijzing naar een klinisch geneticus);
-
de emoties die de klacht bij de vrouw oproept.
Lichamelijk onderzoek
-
Inspecteer borsten, tepels en tepelhof terwijl de patiënt zit of staat, met de armen hangend langs het lichaam. Let daarbij op:
-
borsten: vorm, symmetrie, zwelling;
-
huid: kleur, versterkte unilaterale venetekening, intrekkingen, sinaasappelhuid (peau d’orange), ulceraties, eczeem, verhevenheden;
-
tepels en tepelhof: kleur, vorm, zwellingen, afscheiding, tekenen van ontsteking, lokale huidafwijkingen.
-
-
Laat de patiënt achtereenvolgens de armen naast het hoofd heffen en de handen onder aanspanning van de mm. pectorales majores in de zij plaatsen. Let daarbij op veranderingen in contouren en symmetrie van de borsten en op intrekkingen van huid en tepels. Herhaal dit zo nodig, terwijl de patiënt op de rug ligt.
-
Palpeer borsten, tepels en tepelhof, terwijl de patiënt ligt. Let daarbij op:
-
pijn;
-
consistentie van het borstweefsel;
-
tumoren: lokalisatie, grootte (geschat in centimeters), vorm, consistentie, oppervlak, afgrensbaarheid van omgeving, beweeglijkheid ten opzichte van huid en onderlaag;
-
tepeluitvloed bij circulaire druk op de tepelhof.
-
-
Vraag vrouwen met grote borsten de handen onder het hoofd te leggen bij palpatie van de buitenkwadranten.
-
Onderzoek of er palpabele lymfeklieren zijn. Palpeer terwijl de patiënt zit of ligt, met de armen losjes tegen het lichaam, de:
-
supra- en infraclaviculaire ruimten;
-
okselholtes, palpeer met licht gekromde vingers de ribben en de intercostale ruimtes van boven naar beneden;
-
voorste en achterste okselplooi.
-
-
Palpabele klieren worden beoordeeld op grootte, consistentie en beweeglijkheid.
Alarmsymptomen
| • Een bij palpatie onregelmatig of slecht afgrensbaar knobbeltje. |
| • Een knobbeltje dat vastzit aan de huid en/of onderlaag. |
| • Een knobbeltje bij een postmenopauzale vrouw. |
| • Schilfering of eczeem van de tepel (en niet alleen de tepelhof) die niet goed reageert op corticosteroïden. |
| • Huid- en/of tepelintrekking. |
| • Verdachte lymfeklierzwelling in de oksel, supra- of infraclaviculair (ook zonder knobbeltje in de borst). |
| • Non-puerperale mastitis die persisteert na één week behandeling met antibiotica. |
| • Bruine of bloederige tepeluitvloed. |
| • Tepeluitvloed (ongeacht kleur) bij een postmenopauzale vrouw. |
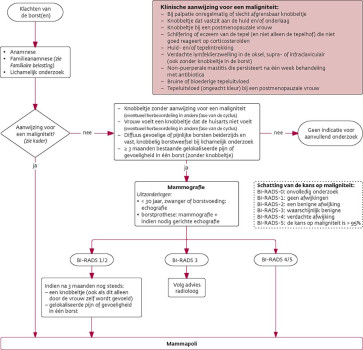
Aanvullend onderzoek
-
Knobbeltje zonder aanwijzing voor een maligniteit (eventueel de vrouw eerst na twee of zes weken terugzien om te beoordelen of de afwijking in een andere fase van de cyclus spontaan is verdwenen).
-
Vrouw voelt een knobbeltje dat de huisarts niet voelt (eventueel de vrouw eerst na twee of zes weken terugzien om te beoordelen of de afwijking in een andere fase van de cyclus spontaan is verdwenen).
-
Diffuus gevoelige of pijnlijke borsten beiderzijds in combinatie met vast, knobbelig borstweefsel bij lichamelijk onderzoek.
-
Langer dan drie maanden bestaande gelokaliseerde pijn of gevoeligheid in één borst (zonder knobbeltje).14 Als de pijnklachten cyclusafhankelijk zijn, kan het mammogram buiten de pijnlijke periode worden gemaakt.
-
Diffuus gevoelige of pijnlijke borsten beiderzijds en geen vast, knobbelig borstweefsel bij lichamelijk onderzoek: er is geen reden om aan borstkanker te denken.
-
Premenopauzaal enkel- of dubbelzijdige, melkachtige of heldere tepeluitvloedTepeluitvloed. Er is geen reden voor ongerustheid over de aanwezigheid van borstkanker. Differentiaal diagnostisch houdt de huisarts rekening met een melkgangfistel uitmondend op de rand van de tepelhof15, een melkgangpapilloom of andere oorzaken, zoals hyperprolactinemie (zie de NHG-Standaard Amenorroe).
-
vrouwen ≥ 30 jaar: mammografieMammografie;16
-
vrouwen < 30 jaar en vrouwen die zwanger zijn of borstvoeding geven: echografieEchografie borst/mamma;16,17
-
vrouwen met siliconenprothesen: mammografie en indien nodig gerichte echografie.18
| Schatting van de kans op maligniteit: |
| BI-RADS-0: onvolledig onderzoek |
| BI-RADS-1: geen afwijkingen |
| BI-RADS-2: een benigne afwijking |
| BI-RADS-3: waarschijnlijk benigne |
| BI-RADS-4: verdachte afwijking |
| BI-RADS-5: de kans op maligniteit is groter dan 95% |
| Mate van densiteit van het borstweefsel: |
| ACR-a: voornamelijk vetweefsel, goed beoordeelbaar |
| ACR-b: verspreid gebieden met klierweefsel, goed beoordeelbaar |
| ACR-c: heterogeen dens klierweefsel, matig beoordeelbaar |
| ACR-d: zeer dens klierweefsel, slecht beoordeelbaar |
Evaluatie
-
Er is sprake van een hoge verdenking op maligniteit. Verwijzing mammapoli is geïndiceerd bij:
-
klinische aanwijzingen voor een maligniteit (zie [tabel 1]);
-
BI-RADS 4 of 5.
-
-
Er is een lage verdenking op maligniteit bij:
-
afwezigheid van een knobbeltje;
-
BI-RADS 1, 2 of 3.
-
Richtlijnen beleid bij klachten van de borst(en)
Voorlichting
-
Niet-afwijkend mammo-/echogram (BI-RADS 1 of 2): dit sluit de aanwezigheid van borstkanker niet uit. Adviseer om terug te komen op het spreekuur indien drie maanden na de uitslag BI-RADS 1 of 2 nog steeds sprake is van een knobbeltje of gelokaliseerde pijn of gevoeligheid in één borst. Benadruk dat het nodig blijft om ook nieuwe klachten of afwijkingen te melden.
-
Stel een vrouw met diffuus pijnlijke of gevoelige borsten beiderzijds met een niet-afwijkend mammo-/echogram (BI-RADS 1 of 2) en mammografisch weinig dicht klierweefsel (ACR a of b) gerust. Er is geen reden om aan borstkanker te denken. Uitleg over mastopathieMastopathie en begrip voor de hinder die de patiënt kan ondervinden zijn daarbij van belang.21
-
Leg een vrouw met diffuus pijnlijkePijnlijke borsten of gevoelige borsten beiderzijds met een niet-afwijkend mammo-/echogram (BI-RADS 1 of 2) en mammografisch dicht klierweefsel (ACR c of d) uit dat door het dichte borstklierweefsel het mammo-/echogram lastiger te beoordelen is, maar dat er geen aanwijzingen zijn gevonden voor een afwijking die verder onderzoek vereist.
-
Periodiek borstzelfonderzoek: periodiek borstzelfonderzoekBorstzelfonderzoek leidt niet tot vermindering van de sterfte aan borstkanker of verbetering van de prognose. Het kan wel leiden tot overdiagnostiek.22 Raad periodiek borstzelfonderzoek bij vrouwen zonder borstkanker in de voorgeschiedenis dan ook niet actief aan. Adviseer de patiënt wel om bij klachten of veranderingen aan de borst die na de menstruatie niet verdwijnen contact met de huisarts op te nemen.
-
Tepeluitvloed: massage van borsten of tepels kan tepeluitvloed onderhouden.
Consultatie en verwijzing
-
bij klinische aanwijzingen voor een maligniteit (zie [tabel 1]);
-
bij BI-RADS 4 of 5;
-
indien er drie maanden na een niet-afwijkend mammogram (BI-RADS 1 of 2) nog steeds sprake is van:
-
een knobbeltje (ook als dit alleen door de vrouw zelf wordt gevoeld);
-
gelokaliseerde pijn of gevoeligheid in één borst.
-
Rol huisarts bij verwijzing naar mammapoli
-
bespreek met de patiënt of zij het wenselijk vindt om contact te houden tijdens het (verdere) diagnostische en behandeltraject;
-
zo ja, vraag de patiënt een afspraak te maken voor een vervolgconsult of telefonisch contact op te nemen bij een diagnose met belangrijke consequenties.
-
samen stil te staan bij de ingrijpende en vaak plotselinge diagnose van kanker en de consequenties daarvan;
-
de patiënt te wijzen op het bestaan van de Monitor BorstkankerzorgMonitor Borstkankerzorg (monitorborstkankerzorg.nl) en voorlichtingsmateriaal (zie kader Informatieve websites);
-
na te gaan of de patiënt de informatie van het ziekenhuis heeft begrepen en desgewenst ondersteuning te bieden bij eventuele keuzes die gemaakt moeten worden, ingaand op de wensen, mogelijkheden en motivatie van de patiënt;
-
desgewenst de patiënt te helpen bij haar voorbereiding op een vervolgconsult met de specialist over het behandelplan (waarover de huisarts zich in overleg met de patiënt zo nodig nader informeert via de specialist). Wijs de patiënt eventueel op de B-bewust-vragenlijsten op www.b-bewust.nl die speciaal zijn ontwikkeld ter voorbereiding op gesprekken met zorgverleners.
Informatieve websites
-
Borstkankervereniging NederlandBorstkankervereniging Nederland; vereniging voor borstkankerpatiënten en mensen met erfelijke aanleg voor borstkanker.
-
www.borstkanker.nl: website van Borstkankervereniging Nederland; informatie over borstkanker, erfelijke belasting en lotgenotencontact.
-
www.b-bewust.nl: op deze website vinden borstkankerpatiënten hulp bij het voorbereiden van gesprekken met de huisarts en medisch specialisten.
-
www.monitorborstkankerzorg.nl: de Monitor Borstkankerzorg combineert ervaringen van patiënten met informatie over het zorgaanbod van ziekenhuizen. Op basis van postcode en patiëntvoorkeuren kan een gemotiveerde keuze worden gemaakt voor een ziekenhuis.
-
www.de-amazones.nl: website voor jonge vrouwen met borstkanker.
-
www.brca.nl en www.oncogen.nl: website voor mensen die (mogelijk) belast zijn met erfelijke borst- en eierstokkanker.
-
www.kanker.nl: informatie, ervaringskennis, lotgenotencontact en het ondersteuningsaanbod rond kanker; een initiatief van KWF Kankerbestrijding, Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) en IKNL (kenniscentrum voor zorgverleners in de oncologie).
-
www.thuisarts.nl: patiëntinformatie op basis van de NHG-Standaard Borstkanker.
-
www.mammarosa.nl: website en app met informatie over borstkanker voor migranten vrouwen en laaggeletterde vrouwen. Zij bieden voorlichtingsmateriaal in twaalf talen en lotgenotencontact.
-
www.erfelijkheid.nl: informatie over erfelijkheid, erfelijke aandoeningen en genetisch onderzoek. Erfelijkheid.nl is een site van het Erfocentrum, het Nationaal Informatiecentrum Erfelijkheid.
-
www.seksualiteit.nl (zoek op borstkanker) www.borstkanker.nl/seksualiteit), www.de-amazones.nl/seksualiteit-na-borstkanker: informatie over seksualiteit na borstkanker.
-
www.kankerspoken.nl: website voor kinderen en jongeren met een vader of moeder met kanker.
Follow-up na behandeling
-
nacontrole betreft het gepland medisch onderzoek om signalen van eventuele terugkeer of nieuwe vormen van kanker op te sporen;
-
nazorg richt zich op het beperken van de ziektelast, revalidatie en het signaleren, begeleiden en behandelen van (late) gevolgen van (de behandeling van) kanker.
Nacontrole
-
Patiënten die een mastectomieMastectomie hebben ondergaan en inmiddels ouder zijn dan 60 jaar, kunnen doorgaans vijf jaar na de primaire behandeling door de behandelend specialist terugverwezen worden naar het bevolkingsonderzoek.
-
Patiënten die een borstsparende operatie hebben ondergaan en inmiddels ouder zijn dan 60 jaar, kunnen doorgaans vijf jaar na de primaire behandeling door de behandelend specialist worden terugverwezen naar de huisarts. De huisarts heeft dan de regie over de nacontrole. Deze bestaat uit jaarlijkse palpatie en om de twee jaar een mammogram. Dit mammogram wordt bij voorkeur gemaakt in het ziekenhuis waar de controles plaatsvonden.In tegenstelling tot screening bij vrouwen met een verhoogd risico zonder borstkanker in de voorgeschiedenis, wordt palpatie hier wel aanbevolen.24
Nazorg
Lymfoedeem en schouderklachten
-
Wees alert op een infectie (zie NHG-Standaard Bacteriële huidinfecties) of trombose.
-
Indien er geen sprake is van een infectie of trombose:
-
Verwijs bij twijfel of het lymfoedeem wordt veroorzaakt door tumorrecidief naar de mammapoli.
-
Verwijs een patiënt met klachten van lymfoedeem naar een oedeemtherapeut (fysiotherapeut gespecialiseerd in oedeem of een huidtherapeut). De oedeemtherapeut zal het volumeverschil tussen links en rechts vaststellen en het stadium van oedeem/fibrosering. Oedeem(fysio)therapieOedeem(fysio)therapie bestaat uit manuele lymfedrainage, compressietherapie (zwachtelen, elastische kous of hemd), oefentherapie en voorlichting over een actieve leefstijl en een gezond gewicht.27
-
Verwijs bij schouderklachten (postoperatief of na bestraling) naar een oncologie- of oedeemfysiotherapeut.
-
Bijwerkingen antihormonale therapie
-
Opvliegers en andere overgangsklachten. Zie de NHG-Standaard De overgang.
-
Gewrichtsklachten.
-
Vooral aan het begin van de behandeling met tamoxifen: trombo-embolische complicaties (bij 1 tot 10% van de vrouwen). Zie de NHG-Standaard Diepe veneuze trombose en longembolie. Overleg met of verwijs naar de behandelend specialist.
-
Vaginale droogheid: dit kan lokaal behandeld worden met zelfzorgmiddelen zoals niet-hormonale vochtinbrengende crèmes en glijmiddel.
-
Langdurig gebruik van tamoxifen geeft een licht verhoogde kans op baarmoederkanker. Wees daarom bij vrouwen die langdurig tamoxifen gebruiken alert bij vaginaal bloedverlies. Zie de NHG-Standaard Vaginaal bloedverlies.
-
Osteoporose is een bijwerking van aromataseremmers.
Vermoeidheid
Gewichtstoename
Hormoontherapie en anticonceptie
Seksualiteit
Terugkeer naar werk
-
Sinds 2012 zijn er bedrijfsarts consulenten oncologie (BACO), bedrijfsartsen die gespecialiseerd zijn in de begeleiding van patiënten met kanker. Zij zijn onder meer werkzaam in oncologische centra, revalidatiecentra en bij arbodiensten. Zij kennen de verschillende therapeutische mogelijkheden voor (ex-)kankerpatiënten die beperkingen ervaren in hun werk. Zij adviseren de huisarts en andere zorgverleners in zowel de eerste als tweede lijn over de terugkeer naar werk en de optimale begeleiding van (ex-)kankerpatiënten. Zie voor een actueel overzicht van bedrijfsartsconsulenten oncologie de website http://www.nvka.nl/baco. Patiënten kunnen samen met de consulent bespreken wat in hun situatie het beste past.
-
Daarnaast bestaan er ambassadeurs van de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). Deze ervaringsdeskundigen bieden laagdrempelige ondersteuning wanneer een werknemer te maken krijgt met kanker en wil (blijven) werken. De ambassadeurs kunnen worden geconsulteerd door werknemers, werkgevers en zorgprofessionals. Zie http://kankerenwerk.nl/coach/.
Familiaire belasting: indicaties voor screening en verwijzing naar een klinisch geneticus
Risicoschatting op basis van familieanamnese
Literatuur
- 1.Bij verwijzing naar NHG-producten: zie www.nhg.org.
- 2.ACR BI-RADS® Atlas 2013. Zie D’Orsi 2013.
- 3.Adank MA, Hes FJ, Van Zelst-Stams WAG, Van den Tol MP, Seynaeve C, Oosterwijk JC. CHEK2-mutatie in Nederlandse borstkankerfamilies. Uitbreiding van de genetische diagnostiek op borstkanker. Ned Tijdschr Geneeskd 2015;159:A8910.
- 4.Anonymus. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet 1996;347:1713-27.
- 5.Anonymus. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet 1997;350:1047-59.
- 6.Antoniou A, Pharoah PDP, Narod S, Risch HA, Eyfjord JE, Hopper JL, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003;72:1117-30.
- 7.Ashikari R, Park K. Huvos AG, Urban JA. Paget’s disease of the breast. Cancer 1970;26:680-5.
- 8.Barlow WE, Lehman CD, Zheng Y, Ballard-Barbash R, Yankaskas BC, Cutter GR, et al. Performance of diagnostic mammography for women with signs or symptoms of breast cancer. J Natl Cancer Inst 2002;94:1151-9.
- 9. Bernstein JL, Teraoka SN, John EM, Andrulis IL, Knight JA, Lapinski R, et al. The CHEK2*1100delC allelic variant and risk of breast cancer: screening results from the Breast Cancer Family Registry. Cancer Epidemiol Biomarkers Prev 2006;15:348-52.
- 10.Berrington de Gonzalez A, Reeves G. Mammographic screening before age 50 years in the UK: comparison of the radiation risks with the mortality benefits. Br J Cancer 2005;93:590-6.Bertrand KA, Tamimi RM, Scott CG, Jensen MR, Pankratz V, Visscher D, et al. Mammographic density and risk of breast cancer by age and tumor characteristics. Breast Cancer Res 2013;15:R104.
- 11.Bond M, Pavey T, Welch K, et al. Systematic review of the psychological consequences of false-positive screening mammograms. Health Technol Assess 2013;17:1-170.
- 12.Broeders MJ, Verbeek AL, Straatman H, et al. Repeated mammographic screening reduces breast cancer mortality along the continuum of age. J Med Screen 2002;9:163-7.
- 13. Brohet RM, Velthuizen ME, Hogervorst FB, Meijers-Heijboer HE, Seynaeve C, Collée MJ, et al. Breast and ovarian cancer risks in a large series of clinically ascertained families with a high proportion of BRCA1 and BRCA2 Dutch founder mutations. J Med Genet 2014;51:98-107.
- 14.Bubien V, Bonnet F, Brouste V, et al. French Cowden Disease Network. J Med Genet 2013;50:255-63.
- 15.Carney PA, Miglioretti DL, Yankaskas BC, Kerlikowske K, Rosenberg R, Rutter CM, et al. Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann Intern Med 2003;138:168-75.
- 16.CHEK2 Breast Cancer Case-Control Consortium. CHEK2*1100 del C and susceptibility to breast cancer: a collaborative analysis involving 10,860 breast cancer cases and 9.065 controls form 10 studies. Am J Hum Genet 2004;74:1175-82.
- 17.Chen S, Parmigiani G. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol 2007;25:1329-33.
- 18.Chen L, Zhou WB, Zhao Y, Liu XA, Ding Q, Zha XM, et al. Bloody nipple discharge is a predictor of breast cancer risk: a meta-analysis. Breast Cancer Rest Treat 2012;132:9-14.
- 19.Cibula D, Gompel A, Mueck AO, La Vecchia C, Hannaford PC, Skouby SO, et al. Hormonal contraception and risk of cancer. Hum Reprod Update 2010;16:631-50.
- 20. Cil T, Fishell E, Hanna W, Sun P, Rawlinson E, Narod SA, et al. Mammographic density and the risk of breast cancer recurrence after breast-conserving surgery. Cancer 2009;115:5780-7.
- 21.Coldman A, Phillips N, Wilson C, et al. Pan-Canadian study of mammography screening and mortality from breast cancer. J Natl Cancer Inst 2014;106:261.
- 22.Collaborative Group on Hormonal Factors in Breast Cancer. Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58209 women with breast cancer and 101986 women without breast cancer. Lancet 2001;358:1389-99.
- 23.Collaborative Group on Hormonal Factors in Breast Cancer. Menarche, menopause, and breast cancer risk: individual participant meta-analysis, including 118 964 women with breast cancer from 117 epidemiological studies. Lancet Oncol 2012;13:1141-51.
- 24. Cristofanilli M, Valero V, Buzdar AU, Kau SW, Broglio KR, Gonzalez-Angulo AM, et al. Inflammatory breast cancer (IBC) and patterns of recurrence: understanding the biology of a unique disease. Cancer 2007;110:1436-44.
- 25.Cummings SR, Tice JA, Bauer S, Browner WS, Cuzick J, Ziv E, et al. Prevention of breast cancer in postmenopausal women: approaches to estimating and reducing risk. J Natl Cancer Inst 2009;101:384-98.
- 26. Dalberg K, Hellborg H, Wärnberg F. Paget’s disease of the nipple in a population based cohort. Breast Cancer Res Treat 2008;111:313-9.
- 27.De Bock GH, Bonnema J, Van der Hage JA, Kievit J, Van de Velde CJH. Effectiveness of routine visits and routine tests in detecting isolated locoregional recurrences after treatment for early-stage invasive breast cancer: a meta-analysis and systematic review. J Clin Oncol 2004;22:4010-8.
- 28.De Bock GH, Van der Hage JA, Putter H, Bonnema J, Bartelink H, Van de Velde CJH. Isolated loco-regional recurrence of breast cancer is more common in young patients and following breast conserving therapy: long-term results of European Organisation for Research and Treatment of Cancer studies. Eur J Cancer 2006;42:351-6.
- 29. De Bruin ML, Sparidans J, Van’t Veer MB, Noordijk EM, Louwman MW, Zijlstra JM, et al. Breast cancer risk in female survivors of Hodgkin’s lymphoma: lower risk after smaller radiation volumes. J Clin Oncol 2009;27:4239-46.
- 30. Devoogdt N, Van Kampen M, Geraerts I, Coremans T, Christiaens MR. Different physical treatment modalities for lymphoedema developing after axillary lymph node dissection for breast cancer: a review. Eur J Obstet Gynecol Reprod Biol 2010;149:3-9.
- 31.Didem K, Ufuk YS, Serdar S, and Zumre A.The comparison of two different physiotherapy methods in treatment of lymphedema after breast surgery. Breast Cancer Res Treat 2005;93:49-54.
- 32. DiSipio T, Rye S, Newman B, Hayes S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol 2013;14:500-15.
- 33.Djulbegovic B, Lyman GH. Screening mammography at 40-49 years: regret or no regret? Lancet 2006;368:2035-7.
- 34.Donker M, van Tienhoven G, Straver ME, Meijnen P, van de Velde CJ, Mansel RE, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014;15:1303-10.
- 35.D’Órsi CJ, Sickles EA, Mendelson EB, Morris EA, et al. ACR BI-RADS® Atlas, Breast Imaging Reporting and Data System. Reston, VA, American College of Radiology; 2013.
- 36.Duijm LEM, Guit GL. Value of breast imaging in women with painful breasts: observational follow up study. BMJ 1998;317:1492-5.
- 37.Dumitrescu RG, Cotarla I. Understanding breast cancer risk: where do we stand in 2005? J Cell Mol Med 2005;9:208-21.
- 38.Eberl MM, Phillips RL Jr, Lamberts H, Okkes I, Mahoney MC. Characterizing breast symptoms in family practice. Ann Fam Med 2008;6:528-33.
- 39.Easton DF. How many more breast cancer predisposition genesare there? Breast Cancer Res 1999;1:14-7.
- 40.Eklund GW, Busby RC, Miller SH, Job JS. Improved imaging of the augmented breast. AJR Am J Roentgenol 1988;151:469-73.
- 41.Elmore JG, Reisch LM, Barton MB, et al. Efficacy of breast cancer screening in the community according to risk level. J Natl Cancer Inst 2005;97:1035-43.
- 42.Friedenreich CM, Thune I, Brinton LA, Albanes D. Epidemiologic issues related to the association between physical activity and breast cancer. Cancer 1998;83:600-10.
- 43.Galvin R, Joyce D, Downey E, Boland F, Fahey T, Hill AK. Development and validation of a clinical prediction rule to identify suspected breast cancer: a prospective cohort study. BMC Cancer 2014;14:743.
- 44.Gezondheidsraad. Bevolkingsonderzoek naar borstkanker: verwachtingen en ontwikkelingen. Den Haag: Gezondheidsraad, 2014, publicatienr. 2014/01.
- 45.Gielissen MFM, Verhagen S, Witjes F, Bleijenberg G. Effects of cognitive behavior therapy in severely fatigued disease-free cancer patients compared with patients waiting for cognitive behavior therapy: a randomized controlled trial. J Clin Oncol 2006;24:4882-7.
- 46. Gierach GL, Ichikawa L, Kerlikowske K, Brinton LA, Farhat GN, Vacek PM, et al. Relationship between mammographic density and breast cancer death in the breast cancer surveillance consortium. J Natl Cancer Inst 2012;104:1218-27.
- 47.Hackshaw AK, Paul EA. Breast self-examination and death from breast cancer: a meta-analysis. Br J Cancer 2003;88:1047-53.
- 48.Hamajima N, Hirose K, Tajima K, Rohan T, Calle EE, Heath CW Jr, et al. Alcohol, tobacco and breast cancer: collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br J Cancer 2002;87:1234-45.
- 49. Hance KW, Anderson WF, Devesa SS, Young HA, Levine PH. Trends in inflammatory breast carcinoma incidence and survival: the surveillance, epidemiology, and end results program at the national cancer institute. J Natl Cancer Inst 2005;97:966-75.
- 50.Handel N. The effect of silicone implants on the diagnosis, prognosis, and treatment of breast cancer. Plast Reconstr Surg 2007;120:81-93.
- 51.Heins MJ, Korevaar JC, Rijken PM, Schellevis FG. For which health problems do cancer survivors visit their general practitioner? Eur J Cancer 2013;49:211-8.
- 52.Hellquist BN, Duffy SW, Abdsaleh S, et al. Effectiveness of population-based service screening with mammography for women ages 40 to 49 years: evaluation of the swedish mammography screening in young women (SCRY) cohort. Cancer 2011;117:714-22.
- 53.Hofvind S, Ponti A, Patnick J, et al. False-positive results in mammographic screening for breast cancer in Europe: a literature review and survey of service screening programmes. J Med Screen 2012;19:57-66.
- 54. Holmberg L, Iversen OE, Rudenstam CM, Hammar M, Kumpulainen E, Jaskiewicz J, et al. HABITS Study Group. Increased risk of recurrence after hormone replacement therapy in breast cancer survivors. J Natl Cancer Inst 2008;100:475-82.
- 55.HPA. Risk of solid cancers following radiation exposure: estimates for the UK population. Health Protection Agency. Radiation, Chemical and Environmental Hazards, 2011;RCE-19.
- 56.Hunter DJ, Willett WC. Diet, body size, and breast cancer. Epidemiol Rev 1993;15:110-32.
- 57.Hussian ST, Gui GP, Lee KS, Plowman PN, Gilmore OJ, Allum WH. Detection of loco-regional recurrence after breastconserving surgery and radiotherapy. J R Coll Surg Edinb 1995;40:163-6.
- 58.Lauby-Secretan B, Scoccianti C, Loomis D, Benbrahim-Tallaa L, Bouvard V, Bianchini F, et al. Breast-cancer screening-viewpont of the IARC Working Group. N Engl J Med 2015;372:2353-8. http://assets.krebsliga.ch/downloads/breast_cancer_screening___viewpoint_of_the_iarc_working_group.pdf
- 59.IKNL. Richtlijn erfelijk en familiair Ovariumcarcinoom (2015). http://www.oncoline.nl/erfelijk-en-familiair-ovariumcarcinoom.
- 60.IKNL. Nederlandse Kankerregistratie. Cijfers over kanker (geraadpleegd 2016). http://www.cijfersoverkanker.nl.
- 61.Imoto S, Jitsuiki Y. Detection of the first recurrence during intensive follow-up of breast cancer patients. Jpn J Clin Oncol 1998;28:597-600.
- 62.Jansen D, Spreeuwenberg P, Heijmans, M. Ontwikkelingen in de zorg voor chronisch zieken. Rapportage 2012. Utrecht: NIVEL, 2012.
- 63.Jonsson H, Tornberg S, Nystrom L, Lenner P. Service screening with mammography of women aged 70-74 years in Sweden. Effects on breast cancer mortality. Cancer Detect Prev 2003;27:360-9.
- 64.Kaas R, Rutgers E.J.Th. Systematisch borstzelfonderzoek is geen nuttige screening, behalve bij genetisch of familiair verhoogd risico op borstkanker. Ned Tijdschr Geneeskd 2008;152:2317-8.
- 65. Kamal RM, Hamed ST, Salem DS. Classification of inflammatory breast disorders and step by step diagnosis. Breast J 2009;15:367-80.
- 66.Kedde H, van de Wiel HB, Weijmar Schultz WC, Wijsen C. Sexual dysfunction in young women with breast cancer. Support Care Cancer 2013;21:271-80.
- 67.Kelsey JL, Berkowitz GS. Breast cancer epidemiology. Cancer Res 1988;48:5615-23.
- 68.Kerlikowske K, Grady D, Rubin SM, Sandrock C, Ernster VL. Efficacy of screening mammography. A meta-analysis. JAMA 1995;273:149-54.
- 69.Kerlikowske K, Smith-Bindman R, Ljung BM, Grady D. Evaluation of abnormal mammography results and palpable breast abnormalities. Ann Intern Med 2003;139:274-84.
- 70.Key TJ, Verkasalo PK, Banks E. Epidemiology of breast cancer. Lancet Oncol 2001;2:133-40.
- 71.KWF Kankerbestrijding. Kanker in Nederland tot 2020 (2011). http://www.kwf.nl/SiteCollectionDocuments/rapport-Kanker-in-Nederland-tot-2020.pdf.
- 72.LETB, Landelijke Evaluatie Team voor bevolkingsonderzoek naar Borstkanker. Landelijke evaluatie van bevolkingsonderzoek naar borstkanker in Nederland 1990-2011/2012, het dertiende evaluatierapport (XIII). Rotterdam: Erasmus MC, 2014a.
- 73.LETB, Landelijke Evaluatie Team voor bevolkingsonderzoek naar Borstkanker. Monitor 2012, Landelijk bevolkingsonderzoek naar borstkanker. Resultaten 1990-2012. Rotterdam: Erasmus MC, 2014b.
- 74.LETB, Landelijke Evaluatie Team voor bevolkingsonderzoek naar Borstkanker. Screeningsresultaten naar BI-RADS 2010-2013 - Landelijke gegevensset. Rotterdam: Erasmus MC, 2015
- 75.Lipworth L, Baily LR, Trichopoulos DM. History of breast-feeding in relation to breast cancer risk: a review of the epidemiologic literature. J Natl Cancer Inst 2000;92:302-12.
- 76. Lu WL, Jansen L, Post WJ, Bonnema J, Van de Velde JC, De Bock GH. Impact on survival of early detection of isolated breast recurrences after the primary treatment for breast cancer: a meta-analysis. Breast Cancer Res Treat 2009;114:403-12.
- 77.Lu W, de Bock GH, Schaapveld M, Baas PC, Wiggers T, Jansen L. The value of routine physical examination in the follow up of women with a history of early breast cancer. Eur J Cancer 2011;47:676-82.
- 78. Maskarinec G, Pagano IS, Little MA, Conroy SM, Park SY, Kolonel LN. Mammographic density as a predictor of breast cancer survival: the Multiethnic Cohort. Breast Cancer Res 2013;15:7.
- 79.McCormack VA, Dos Santos Silva I. Breast density and parenchymal patterns as markers of breast cancer risk: a meta-analysis. Cancer Epidemiol Biomarkers Prev 2006;15:1159-69.
- 80. McIntosh SA, Horgan K. Augmentation mammoplasty: effect on diagnosis of breast cancer. J Plast Reconstr Aesthet Surg 2008;61:124-9.
- 81.McPherson K, Steel CM, Dixon JM. ABC of breast diseases. Breast cancer-epidemiology, risk factors, and genetics. BMJ 2000;321:624-8.
- 82. Montgomery DA, Krupa K, Cooke TG. Follow-up in breast cancer: does routine clinical examination improve outcome? A systematic review of the literature. Br J Cancer 2007;97:1632-41.
- 83.Moskowitz M. Breast cancer: age-specific growth rates and screening strategies. Radiology 1986;161:37-41.
- 84.Moss HA, Britton PD, Flower CD, Freeman AH, Lomas DJ, Warren RM. How reliable is modern breast imaging in differentiating benign from malignant breast lesions in the symptomatic population? Clin Radiol 1999;54:676-82.
- 85.Moss SM, Cuckle H, Evans A, Johns L, Waller M, Bobrow L. Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years’ follow-up: a randomised controlled trial. Lancet 2006;368:2053-60.
- 86.NABON. Richtlijn borstkanker 2012, met modulaire updates tot maart 2016. http://www.oncoline.nl/mammacarcinoom.
- 87.Nelson HD, Fu R, Goddard K, Mitchell JP, Okinaka-Hu L, Pappas M, Zakher B. Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer: Systematic Review to Update the U.S. Preventive Services Task Force Recommendation. Evidence Synthesis No. 101. AHRQ Publication No. 12-05164-EF-1. Rockville, MD: Agency for Healthcare Research and Quality; 2013. Zie http://www.ncbi.nlm.nih.gov/books/NBK179201/pdf/Bookshelf_NBK179201.pdf.
- 88.NHSBSP Publication No 54. Review of radiation risk in breast screening. 2003. www.cancerscreening.nhs.uk.Nielen MMJ, Spronk I, Davids R, Zwaanswijk M, Verheij RA, Korevaar JC. Incidentie en prevalentie van gezondheidsproblemen in de Nederlandse huisartsenpraktijk in 2014. Uit: NIVEL Zorgregistraties eerste lijn (internet). 2014: www.nivel.nl/node/4096.
- 89.Nieuwenhuis MH, Kets CM, Murphy-Ryan M, et al. Cancer risk and genotypephenotype correlations in PTEN hamartoma tumor syndrome. Fam Cancer 2014;13:57-63.
- 90.Norman SA, Russell LA, Weber AL, et al. Protection of mammography screening against death from breast cancer in women aged 40-64 years. Cancer Causes Control 2007;18:909-18.
- 91. Noroozian M, Stein LF, Gaetke-Udager K, Helvie MA. Long-term clinical outcomes in women with breast pain in the absence of additional clinical findings: mammography remains indicated. Breast Cancer Res Treat 2015;149:417-24.
- 92.Okkes I, Oskam S, Van Boven K, Lamberts H. EFP: episodes of care in family practice. Epidemiological data based on the routine use of the international classification of primary care (ICPC) in the transition project of the university of Amsterdam (1985-2003) (CD-rom). Amsterdam: AMC, 2005.
- 93.Paci E, Euroscreen Working Group. Summary of the evidence of breast cancer service screening outcomes in Europe and first estimate of the benefit and harm balance sheet. J Med Screen 2012;19:5-13.
- 94.Palli D, Rosselli Del Turco M, Buiatti E, Ciatto S, Crocetti E, Paci E. Time interval since last test in a breast cancer screening programme: a case-control study in Italy. J Epidemiol Community Health 1989;43:241-8.
- 95.Palli D, Russo A, Saieva C, Ciatto S, Rosselli Del TM, Distante V, et al. Intensive vs clinical follow-up after treatment of primary breast cancer: 10-year update of a randomized trial. National research council project on breast cancer followup. JAMA 1999;281:1586.
- 96.Peto J, Collins N, Barfoot R, Seal S, Warren W, Rahman N, et al. Prevalence of BRCA1 and BRCA2 gene mutations in patients with early-onset breast cancer. J Natl Cancer Inst 1999;91:943-9.
- 97. Pisano ED, Gatsonis C, Hendrick E, Yaffe M, Baum JK, Acharyya S, et al. Digital Mammographic Imaging Screening Trial (DMIST) Investigators Group. Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 2005;353:1773-83.
- 98.Puetz TW, Herring MP. Differential effects of exercise on cancer-related fatigue during and following treatment A meta-analysis. Am J Prev Med 2012;43:e1-e24.
- 99.RIVM. Feiten en cijfers over volksgezondheid en zorg (2015). https://www.volksgezondheidenzorg.info/onderwerp/borstkanker.
- 100.Roder D, Houssami N, Farshid G, et al. Population screening and intensity of screening are associated with reduced breast cancer mortality: evidence of efficacy of mammography screening in Australia. Breast Cancer Res Treat 2008;108:409-416.
- 101. Roeke T, Van Bommel AC, Gaillard-Hemmink MP, Hartgrink HH, Mesker WE, Tollenaar RA. The additional cancer yield of clinical breast examination in screening of women at hereditary increased risk of breast cancer: a systematic review. Breast Cancer Res Treat 2014;147:15-23.
- 102. Roorda C, Berendsen AJ, Groenhof F, Van der Meer K, De Bock GH. Increased primary healthcare utilisation among women with a history of breast cancer. Support Care Cancer 2013;21:941-9.
- 103.Rosselli Del TM, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA 1994;271:1593-7.
- 104.Sharif S, Moran A, Huson SM, Iddenden R, Shenton A, Howard E, Evans DG. Women with neurofibromatosis 1 are at a moderately increased risk of developing breast cancer and should be considered for early screening. J Med Genet 2007;44:481-4.
- 105.Shin SU, Chang JM, Bae MS, Lee SH, Cho N, Seo M, et al. Comparative evaluation of average glandular dose and breast cancer detection between single-view digital breast tomosynthesis (DBT) plus single-view digital mammography (DM) and two-view DM: correlation with breast thickness and density. Eur Radiol 2015;25:1-8.
- 106.Stankovic T, Kidd AM, Sutcliffe A, McGuire GM, Robinson P, Weber P, et al. ATM mutations and phenotypes in ataxiatelangiectasia families in the British Isles: expression of mutant ATM and the risk of leukemia, lymphoma, and breast cancer. Am J Hum Genet 1998;62:334-45.
- 107.STOET/VKGN. Erfelijke tumoren. Richtlijnen voor diagnostiek en preventie. Utrecht: Stichting Opsporing Erfelijke Tumoren (STOET) en Vereniging Klinische Genetica Nederland (VKGN), 2010. http://stoet.nl/uploads/richtlijnenboekje.pdf.
- 108.Tabar L, Faberberg G, Day NE, Holmberg L. What is the optimum interval between mammographic screening examinations? An analysis based on the latest results of the Swedish two-county breast cancer screening trial. Br J Cancer 1987;55:547-51.
- 109.Tabar L, Fagerberg G, Duffy SW, Day NE, Gad A, Grontoft O. Update of the Swedish two-county program of mammographic screening for breast cancer. Radiol Clin North Am 1992;30:187-210.
- 110.Tan MH, Mester JL, Ngeow J, et al. Lifetime cancer risks in individuals with germline PTEN mutations. Clin cancer Res 2012;18:400-7.
- 111.Tinnemans JGM, Van Lanschot JJB. De melkgangfistel: een hardnekkig probleem dat adequaat te behandelen is. Ned Tijdschr Geneeskd 2004;148:405-8.
- 112. Tumyan L, Hoyt AC, Bassett LW. Negative predictive value of sonography and mammography in patients with focal breast pain. Breast J 2005;11:333-7.
- 113. Uematsu T. Screening and diagnosis of breast cancer in augmented women. Breast Cancer 2008;15:159-64.
- 114. Van den Biggelaar FJ, Kessels AG, Van Engelshoven JM, Flobbe K. Strategies for digital mammography interpretation in a clinical patient population. Int J Cancer 2009;125:2923-9.
- 115. Van der Heiden-van der Loo M, Siesling S, Wouters MW, Van Dalen T, Rutgers EJ, Peeters PH. The Value of Ipsilateral Breast Tumor Recurrence as a Quality Indicator: Hospital Variation in the Netherlands. Ann Surg Oncol 2015;22:522-8.
- 116.Van Dijck JA, Broeders MJ, Verbeek AL. Mammographic screening in older women. Is it worthwhile? Drugs Aging 1997;10:69-79.
- 117.Van Schoor G, Moss SM, Otten JD, et al. Effective biennial mammographic screening in women aged 40-49. Eur J Cancer 2010;46:3137-40.
- 118.Van Sprundel TC, Tollenaar RAEM. Familiaire belasting. In: Handboek Mammacarcinoom. Utrecht: De Tijdstroom, 2007.
- 119.Van Uden DJ, Westenberg AH, Van Laarhoven HW, Meijer JW, De Wilt JH, Blanken-Peeters CF. Mastitis als uiting van een maligniteit. Ned Tijdschr Geneeskd 2014;158:A7591.
- 120.Visser O, Siesling S, Van Dijck JAAM. Incidence of cancer in the Netherlands 1999/2000. Utrecht: Vereniging van Integrale Kankercentra, 2003.
- 121.Visser O, Van der Kooy K, Van Peppen AM, Ory FG, Van Leeuwen FE. Breast cancer risk among first-generation migrants in the Netherlands. Br J Cancer 2004;90:2135-7.
- 122.VKGN. Richtlijn het informeren van familieleden bij erfelijke aanleg voor kanker (2012). http://www.vkgn.org/index.php/vakinformatie/richtlijnen-en-protocollen/erfelijke-tumoren/178-concept-richtlijn-informeren-familieleden-bij-erfelijke-kanker/file.
- 123.Wagman LD, Sanders RD, Terz JJ, Beatty JD, Kokal WA, Riihimaki DU. The value of symptom directed evaluation in the surveillance for recurrence of carcinoma of the breast. Surg Gynecol Obstet 1991;172:191-6.
- 124.Walker S, Hyde C, Hamilton W. Risk of breast cancer in symptomatic women in primary care: a case-control study using electronic records. Br J Gen Pract 2014;64:788-93.
- 125. Warner E, Messersmith H, Causer P, Eisen A, Shumak R, Plewes D. Systematic review: using magnetic resonance imaging to screen women at high risk for breast cancer. Ann Intern Med 2008;148:671-9.
- 126.Weischer M, Bojesen SE, Ellervik C, et al: CHEK2*1100delC genotyping for clinical assessment of breast cancer risk: Meta-analysis of 26,000 patient cases and 27,000 controls. J Clin Oncol 2008;26:542-8.
- 127.White E. Projected changes in breast cancer incidence due to the trend toward delayed childbearing. Am J Public Health 1987;77:495-7.
- 128. Witteveen A, Kwast AB, Sonke GS, IJzerman MJ, Siesling. Survival after locoregional recurrence or second primary breast cancer: impact of the disease-free interval. PLoS One 2015;10:e0120832.
- 129. Yaffe MJ, Bloomquist AK, Hunter DM, Mawdsley GE, Chiarelli AM, Muradali D, et al. Comparative performance of modern digital mammography systems in a large breast screening program. Med Phys 2013;40:121915.
- 130.Zegers, M, Heijmans, M, Rijken M. Ondersteuningsbehoeften van (ex-)kankerpatiënten en de rol van de huisarts. Huisarts Wet 2010;53:415.
- 131.Zonderland HM. The role of ultrasound in the diagnosis of breast cancer [Proefschrift]. Leiden: Rijksuniversiteit Leiden, 2000.
Reacties
Er zijn nog geen reacties.