Samenvatting
-
De standaard bevat nu ook richtlijnen voor het beleid bij acute ischemie van het (onder)been in verband waarmee de vormen van perifeer arterieel vaatlijden die geleidelijk ontstaan nu worden aangeduid met de term ‘chronisch obstructief arterieel vaatlijden’.
-
Voor secundaire preventie van hart- en vaatziekten wordt de NHG-Standaard Cardiovasculair risicomanagement gevolgd.
-
De werkwijze voor het meten van de enkel-armindex is meer gedetailleerd weergegeven.
-
Bij claudicatio intermittens wordt voortaan gesuperviseerde looptherapie aanbevolen.
-
Er is aandacht voor samenwerkingsafspraken tussen alle zorgverleners in de eerste en de tweede lijn.
-
Maak voor het beleid bij symptomatisch perifeer arterieel vaatlijden onderscheid tussen enerzijds acute ischemie van het (onder)been en anderzijds chronisch obstructief arterieel vaatlijden. Chronisch obstructief arterieel vaatlijden kan verdeeld worden in twee uitingsvormen: claudicatio intermittens en kritieke ischemie.
-
Verwijs bij verdenking op acute ischemie met spoed voor ontstolling en zo nodig revascularisatie.
-
Bepaal voor het bevestigen van de diagnose perifeer arterieel vaatlijden de enkel-armindex.
-
Het beleid bij chronisch obstructief arterieel vaatlijden omvat in alle gevallen cardiovasculair risicomanagement en stoppen met roken.
-
Verwijs bij claudicatio intermittens voor gesuperviseerde looptraining.
-
Verwijs bij kritieke ischemie voor aanvullend onderzoek en aanvullende behandeling.
Inbreng van de patiënt
Afweging door de huisarts
Delegeren van taken
Inleiding
Achtergronden
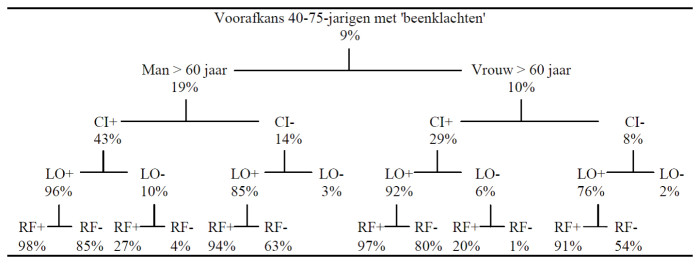
Epidemiologie
Prognose en beloop
Indeling van perifeer arterieel vaatlijden
-
Pijn in rust.
-
Afwezige pulsaties (Pulseless): afwezigheid van voetpulsaties suggereert de aanwezigheid van acute ischemie. Afwezigheid van dopplersignalen over de voetarteriën is een extra indicatie voor acute ischemie.
-
Bleekheid (Pallor): patiënten ervaren vaak veranderingen in kleur en temperatuur van de voet.
-
Paresthesieën: veel mensen ervaren een doof gevoel.
-
Paralyse: de intrinsieke voetspieren zijn hierbij vaak als eerste aangedaan.
Richtlijnen diagnostiek
Anamnese
-
Hoe lang bestaan de klachten? Is er (snelle) progressie?
-
Is er sprake van klachten die wijzen op acute ischemie van het been:
-
pijn in rust;
-
gevoelsstoornissen (doof gevoel);
-
spierzwakte;
-
bleekheid.
-
-
Is er sprake van klachten die passen bij claudicatio intermittens:
-
pijn en andere vervelende sensaties (moe, stijf, krampen, temperatuurverschillen) in het been (dat wil zeggen in een spiergroep van de bilregio of het been), die optreden bij inspanning en verminderen in rust;
-
links-rechtsverschil.
-
-
Is er sprake van klachten die wijzen op kritische ischemie van het been:
-
rustpijn en/of nachtelijke pijn (vooral in de voorvoet of tenen), die afneemt als de patiënt opstaat of het aangedane been laat hangen;
-
afwijkingen van huid of nagels aan de voeten, zoals wondjes of zweertjes.
-
-
Kwaliteit van leven:
-
ervaart de patiënt beperkingen van lichamelijke (waaronder ook seksuele) activiteiten, werk of alledaagse bezigheden? wat is de maximale loopafstand (meer of minder dan 100 meter)?
-
-
leeftijd ≥ 50 jaar;
-
doorgemaakte hart- en vaatziekten, diabetes mellitus, of reumatoïde artritis;
-
geslacht (mannen hoger risico dan vrouwen);
-
roken;
-
familieanamnese (hart- en vaatziekten bij ouders, broers of zusters voor het 65e levensjaar);
-
voedingspatroon afwijkend van de richtlijnen goede voeding;
-
overmatig alcoholgebruik (vrouwen meer dan 1 à 2 glazen/dag, mannen meer dan 2 à 3 glazen/dag);
-
gebrek aan lichamelijke activiteit (minder dan 5 dagen/week 30 min/dag, bijvoorbeeld fietsen, stevig wandelen of tuinieren).
-
donkere huidskleur.
Lichamelijk onderzoek
-
Arterieel:
-
ontbrekende arteriële pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis. Palpeer de a. poplitea als de a. femoralis pulseert, maar palpaties over de voetarteriën ontbreken;
-
souffle bij auscultatie van de a. femoralis met behulp van de stethoscoop. Let op dat te grote druk van de stethoscoop een artificiële souffle kan opwekken;
-
lagere huidtemperatuur van voet en onderbeen bij palpatie met de handrug;
-
bleekheid van het been.
-
-
Neurologisch:
-
gevoelsstoornissen van het been (vaak de interdigitale ruimte/voetrug tussen de eerste en tweede straal);
-
spierzwakte van het been (vaak zwakte/motorische uitval van de intrinsieke voetspieren).
-
-
verzwakte arteriële pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis;
-
souffle bij auscultatie van de a. femoralis;
-
lagere huidtemperatuur van voeten en onderbenen bij palpatie met de handrug;
-
trofische stoornissen: beoordeel de huid (vooral van de tenen, met aandacht voor wondjes), nagels, beharing van voeten en onderbenen.
Aanvullend onderzoek
-
klachten van claudicatio intermittens;
-
huidtemperatuur van één voet duidelijk lager dan van de andere voet;
-
afwijkende pulsaties van de a. tibialis posterior en/of a. dorsalis pedis aan een voet;
-
souffle bij auscultatie van de a. femoralis.
| de hoogste systolische bloeddruk (a. dorsalis pedis of a. tibialis posterior) van de linkerenkel | |
| Enkel-armindex links = | |
| de hoogste systolische bloeddruk (a. brachialis) van beide armen | |
| de hoogste systolische bloeddruk (a. dorsalis pedis of a. tibialis posterior) van de rechterenkel | |
| Enkel-armindex rechts = | |
| de hoogste systolische bloeddruk (a.brachialis) van beide armen |
| Methode |
|
| Patiënt |
|
| Materiaal |
|
| Plaatsing van de manchet |
|
| Meten van de systolische bloeddruk |
|
| Volgorde |
|
| Bepaling van de enkel-armindex |
|
Evaluatie
-
chronisch obstructief arterieel vaatlijden is vrijwel zeker (kans > 95%) bij een eenmalige enkel-armindex kleiner dan 0,8 óf bij een gemiddelde van 3 bepalingen kleiner dan 0,9;
-
chronisch obstructief arterieel vaatlijden is vrijwel uitgesloten (kans < 1%) bij een eenmalige enkel-armindex groter dan 1,1 óf bij een gemiddelde van 3 bepalingen groter dan 1,0;
-
bij een gemiddelde enkel-armindex van 0,9 tot en met 1,0 kan de diagnose chronisch obstructief arterieel vaatlijden niet met zekerheid worden gesteld. De huisarts overweegt alternatieve diagnosen. Bij een aanhoudend vermoeden van chronisch obstructief arterieel vaatlijden volgt verwijzing voor nadere diagnostiek.
| EAI < 0,8 (1x) of < 0,9 (3x) | 0,9 < EAI < 1,0 | EAI > 1,1 (1x) of 1,0 (3x) |
|---|---|---|
| Chronisch obstructief arterieel vaatlijden aangetoond |
Chronisch obstructief arterieel vaatlijden mogelijk
|
Chronisch obstructief arterieel vaatlijden uitgesloten
|
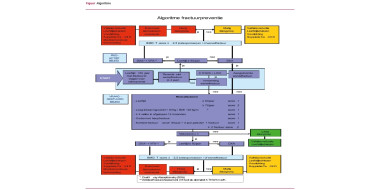
Richtlijnen beleid
Voorlichting
Acute ischemie
Chronisch obstructief arterieel vaatlijden
Niet-medicamenteuze behandeling
Acute ischemie
Chronisch obstructief arterieel vaatlijden
Medicamenteuze behandeling
Acute ischemie
Chronisch obstructief arterieel vaatlijden
Controles
Controles bij claudicatio intermittens nadat de diagnose is gesteld
-
het beloop van de klachten, de ondervonden last in werk en vrije tijd, de mate van (im)mobiliteit en sociale belemmeringen;
-
zelfmanagement;
-
de mate waarin de adviezen over stoppen met roken en looptraining zijn opgevolgd en de moeilijkheden die daarbij zijn ondervonden;
-
de regulatie van cardiovasculaire risicofactoren zoals vastgelegd in het individueel behandelplan.
Controles na revascularisatie of amputatie
Verwijzing
Spoedverwijzing
-
als een bepaling van de enkel-armindex niet in eigen beheer kan worden uitgevoerd (diagnostiek);
-
bij een gemiddelde enkel-armindex van 0,9 tot en met 1,0 en twijfel over de diagnose (diagnostiek);
-
bij patiënten met diabetes mellitus en een vermoeden van chronisch obstructief arterieel vaatlijden (diagnostiek);
-
met snelle progressie van de klachten (behandelopties bespreken);
-
met blijvende klachten of duidelijke subjectieve invalidering ondanks gesuperviseerde looptraining na 6 maanden (behandelopties bespreken).
Samenwerkingsafspraken
Totstandkoming
Literatuur
- 1.Bij verwijzing naar NHG-producten: zie www.nhg.org.
- 2.Aboyans V, Lacroix P, Preux PM, Vergnenegre A, Ferrieres J, Laskar M. Variability of ankle-arm index in general population according to its mode of calculation. Int Angiol 2002;21:237-43. Aboyans V, Criqui MH, McClelland RL, Allison MA, McDermott MM, Goff DC, Jr. et al. Intrinsic contribution of gender and ethnicity to normal ankle-brachial index values: the Multi-Ethnic Study of Atherosclerosis (MESA). J Vasc Surg 2007;45:319-27.
- 3.Aboyans V, Criqui MH, Abraham P, Allison MA, Creager MA, Diehm C, et al. Measurement and interpretation of the ankle-brachial index: a scientific statement from the American Heart Association. Circulation 2012;126:2890-909.
- 4.Adam DJ, Beard JD, Cleveland T, Bell J, Bradbury AW, Forbes JF, et al. Bypass versus angioplasty in severe ischaemia of the leg (BASIL): multicentre, randomised controlled trial. Lancet 2005;366:1925-34.
- 5.Allison MA, Aboyans V, Granston T, McDermott MM, Kamineni A, Ni H, et al. The relevance of different methods of calculating the ankle-brachial index: the multi-ethnic study of atherosclerosis. Am J Epidemiol 2010a;171:368-76.
- 6.Allison MA, Peralta CA, Wassel CL, Aboyans V, Arnett DK, Cushman M, et al. Genetic ancestry and lower extremity peripheral artery disease in the Multi-Ethnic Study of Atherosclerosis. Vasc Med 2010b;15:351-9.
- 7.Amighi J, Sabeti S, Schlager O, Francesconi M, Ahmadi R, Minar E, et al. Outcome of conservative therapy of patients with severe intermittent claudication. Eur J Vasc Endovasc Surg 2004;27:254-8.
- 8.Anderson JD, Epstein FH, Meyer CH, Hagspiel KD, Wang H, Berr SS, et al. Multifactorial determinants of functional capacity in peripheral arterial disease: uncoupling of calf muscle perfusion and metabolism. J Am Coll Cardiol 2009;54:628-35.
- 9.Aquino R, Johnnides C, Makaroun M, Whittle JC, Muluk VS, Kelley ME, et al. Natural history of claudication: long-term serial follow-up study of 1244 claudicants. J Vasc Surg 2001;34:962-70.
- 10.Bachoo P, Thorpe PA, Maxwell H, Welch K. Endovascular stents for intermittent claudication. Cochrane Database Syst Rev 2010;CD003228.
- 11.Bendermacher BL, Willigendael EM, Teijink JA, Prins MH. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication. Cochrane Database Syst Rev 2006;CD005263.
- 12.Bendermacher BL. Peripheral Arterial Disease. Screening, Diagnosis and Conservative Treatment [proefschrift]. Maastricht: Maastricht University Press. 2007.
- 13.Breek JC, Hamming JF, De Vries J, Aquarius AE, Van Berge Henegouwen DP. Quality of life in patients with intermittent claudication using the World Health Organisation (WHO) questionnaire. Eur J Vasc Endovasc Surg 2001;21:118-22.
- 14.Breek JC, Hamming JF, De Vries J, Van Berge Henegouwen DP, Van Heck GL. The impact of walking impairment, cardiovascular risk factors, and comorbidity on quality of life in patients with intermittent claudication. J Vasc Surg 2002;36:94-9.
- 15.Bulmer AC, Coombes JS. Optimising exercise training in peripheral arterial disease. Sports Med 2004;34:983-1003.
- 16.Carmelli D, Fabsitz RR, Swan GE, Reed T, Miller B, Wolf PA. Contribution of genetic and environmental influences to ankle-brachial blood pressure index in the NHLBI Twin Study. National Heart, Lung, and Blood Institute. Am J Epidemiol 2000;151:452-8.
- 17.Collins R, Burch J, Cranny G, Aguiar-Ibáñez R, Craig D, Wright K, et al. Duplex ultrasonography, magnetic resonance angiography, and computed tomography angiography for diagnosis and assessment of symptomatic, lower limb peripheral arterial disease: systematic review. BMJ 2007;334:1257.
- 18.Cosmi B, Conti E, Coccheri S. Anticoagulants (heparin, low molecular weight heparin and oral anticoagulants) for intermittent claudication. Cochrane Database Syst Rev 2001;CD001999.
- 19.Criqui MH, Denenberg JO, Langer RD, Fronek A. The epidemiology of peripheral arterial disease: importance of identifying the population at risk. Vasc Med 1997;2:221-6.
- 20.Criqui MH. Peripheral arterial disease--epidemiological aspects. Vasc Med 2001;6:3-7.
- 21.Criqui MH, Vargas V, Denenberg JO, Ho E, Allison M, Langer RD, et al. Ethnicity and peripheral arterial disease: the San Diego Population Study. Circulation 2005;112:2703-7.
- 22.CVZ. Farmacotherapeutisch Kompas 2012. College voor zorgverzekeringen. http://www.fk.cvz.nl/ .
- 23.Dachun X, Jue L, Liling Z, Yawei X, Dayi H, Pagoto SL, et al. Sensitivity and specificity of the ankle--brachial index to diagnose peripheral artery disease: a structured review. Vasc Med 2010;15:361-9.
- 24.Dawson DL, Cutler BS, Hiatt WR, Hobson RW, Martin JD, Bortey EB, et al. A comparison of cilostazol and pentoxifylline for treating intermittent claudication. Am J Med 2000;109:523-30.
- 25.De Smet AA, Visser K, Kitslaar PJ. Duplex scanning for grading aortoiliac obstructive disease and guiding treatment. Eur J Vasc Surg 1994;8:711-5.
- 26.De Vries SO, Hunink MG, Polak JF. Summary receiver operating characteristic curves as a technique for meta-analysis of the diagnostic performance of duplex ultrasonography in peripheral arterial disease. Acad Radiol 1996;3:361-9.
- 27.De Vries SO, Visser K, De Vries JA, Wong JB, Donaldson MC, Hunink MG. Intermittent claudication: cost-effectiveness of revascularization versus exercise therapy. Radiology 2002;222:25-36.
- 28.Decrinis M, Doder S, Stark G, Pilger E. A prospective evaluation of sensitivity and specificity of the ankle/brachial index in the follow-up of superficial femoral artery occlusions treated by angioplasty. Clin Investig 1994;72:592-7.
- 29.Diehm C, Schuster A, Allenberg JR, Darius H, Haberl R, Lange S, et al. High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: cross-sectional study. Atherosclerosis 2004;172:95-105.
- 30.Dormandy J, Heeck L, Vig S. The natural history of claudication: risk to life and limb. Semin Vasc Surg 1999;12:123-37.
- 31.Elsman BH, Legemate DA, Van der Heijden FH, De Vos HJ, Mali WP, Eikelboom BC. Impact of ultrasonographic duplex scanning on therapeutic decision making in lower-limb arterial disease. Br J Surg 1995;82:630-3.
- 32.Feinglass J, McCarthy WJ, Slavensky R, Manheim LM, Martin GJ. Effect of lower extremity blood pressure on physical functioning in patients who have intermittent claudication. The Chicago Claudication Outcomes Research Group. J Vasc Surg 1996;24:503-11.
- 33.Fowkes F, Leng GC. Bypass surgery for chronic lower limb ischaemia. Cochrane Database Syst Rev 2008;CD002000.
- 34.Fowkes FG, Housley E, Macintyre CC, Prescott RJ, Ruckley CV. Variability of ankle and brachial systolic pressures in the measurement of atherosclerotic peripheral arterial disease. J Epidemiol Community Health 1988;42:128-33.
- 35.Fowkes FG, Housley E, Riemersma RA, Macintyre CC, Cawood EH, Prescott RJ, et al. Smoking, lipids, glucose intolerance, and blood pressure as risk factors for peripheral atherosclerosis compared with ischemic heart disease in the Edinburgh Artery Study. Am J Epidemiol 1992;135:331-40.
- 36.Fowkes FG, Gillespie IN. Angioplasty (versus non surgical management) for intermittent claudication. Cochrane Database Syst Rev 2000;CD000017.
- 37.Fratezi AC, Albers M, De Luccia ND, Pereira CA. Outcome and quality of life of patients with severe chronic limb ischaemia: a cohort study on the influence of diabetes. Eur J Vasc Endovasc Surg 1995;10:459-65.
- 38.Fritschi C, Collins EG, O’Connell S, McBurney C, Butler J, Edwards L. The Effects of Smoking Status on Walking Ability and Health-Related Quality of Life in Patients With Peripheral Arterial Disease. J Cardiovasc Nurs 2013;28:380-6.
- 39.Gardner AW, Skinner JS, Cantwell BW, Smith LK. Prediction of claudication pain from clinical measurements obtained at rest. Med Sci Sports Exerc 1992;24:163-70.
- 40.Gardner AW, Killewich LA, Montgomery PS, Katzel LI. Response to exercise rehabilitation in smoking and nonsmoking patients with intermittent claudication. J Vasc Surg 2004;39:531-8.
- 41.Gardner AW, Montgomery PS, Parker DE. Optimal exercise program length for patients with claudication. J Vasc Surg 2012;55:1346-54.
- 42.Girolami B, Bernardi E, Prins MH, Ten Cate JW, Hettiarachchi R, Prandoni P, et al. Treatment of intermittent claudication with physical training, smoking cessation, pentoxifylline, or nafronyl: a meta-analysis [see comments]. Arch Intern Med 1999;159:337-45. Guidon M, McGee H. Exercise-based interventions and health-related quality of life in intermittent claudication: a 20-year (1989-2008) review. Eur J Cardiovasc Prev Rehabil 2010;17:140-54.
- 43.Hamalainen H, Ronnemaa T, Halonen JP, Toikka T. Factors predicting lower extremity amputations in patients with type 1 or type 2 diabetes mellitus: a population-based 7-year follow-up study. J Intern Med 1999;246:97-103.
- 44.Heijenbrok-Kal MH, Kock MC, Hunink MG. Lower extremity arterial disease: multidetector CT angiography meta-analysis. Radiology 2007;245:433-9.
- 45.Herman SD, Liu K, Tian L, Guralnik JM, Ferrucci L, Criqui MH, et al. Baseline lower extremity strength and subsequent decline in functional performance at 6-year follow-up in persons with lower extremity peripheral arterial disease. J Am Geriatr Soc 2009;57:2246-52.
- 46.Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;344:1608-21.
- 47.Hirsch AT, Criqui MH, Treat-Jacobson D, Regensteiner JG, Creager MA, Olin JW, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001;286:1317-24.
- 48.Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creager MA, Halperin JL, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation 2006;113:e463-e654.
- 49.Hooi JD, Stoffers HEJH. The prognosis of non-crtical limb ischaemia: a systematic review. Br J gen Pract 1999;49:49-55.
- 50.Hooi JD, Kester AD, Stoffers HE, Overdijk MM, Van Ree JW, Knottnerus JA. Incidence of and risk factors for asymptomatic peripheral arterial occlusive disease: a longitudinal study. Am J Epidemiol 2001;153:666-72.
- 51.Hooi JD, Stoffers HEJH, Kester AD, Van Ree JW, Knottnerus JA. Peripheral arterial occlusive disease: prognostic value of signs, symptoms, and the ankle-brachial pressure index. Med Decis Making 2002;22:99-107.
- 52.Ingolfsson IO, Sigurdsson G, Sigvaldason H, Thorgeirsson G, Sigfusson N. A marked decline in the prevalence and incidence of intermittent claudication in Icelandic men 1968-1986: a strong relationship to smoking and serum cholesterol--the Reykjavik Study. J Clin Epidemiol 1994;47:1237-43.
- 53.Jepson RG, Fowkes FG, Donnan PT, Housley E. Alcohol intake as a risk factor for peripheral arterial disease in the general population in the Edinburgh Artery Study. Eur J Epidemiol 1995;11:9-14.
- 54.Kitslaar PJEHM. Consensus diagnostiek en behandeling van arteriele claudicatio intermittens. Ned Tijdschr Geneeskd 1997;141:2396.
- 55.Kleijnen J, Mackerras D. Vitamin E for intermittent claudication. Cochrane Database Syst Rev 2000;CD000987.
- 56.Klein S, Hage JJ. Measurement, calculation, and normal range of the ankle-arm index: a bibliometric analysis and recommendation for standardization. Ann Vasc Surg 2006;20:282-92.
- 57.Klevsgard R, Hallberg IR, Risberg B, Thomsen MB. Quality of life associated with varying degrees of chronic lower limb ischaemia: comparison with a healthy sample. Eur J Vasc Endovasc Surg 1999;17:319-25.
- 58.Klevsgard R, Hallberg IR, Risberg B, Thomsen MB. The effects of successful intervention on quality of life in patients with varying degrees of lower-limb ischaemia. Eur J Vasc Endovasc Surg 2000;19:238-45.
- 59.Klevsgard R, Risberg BO, Thomsen MB, Hallberg IR. A 1-year follow-up quality of life study after hemodynamically successful or unsuccessful surgical revascularization of lower limb ischemia. J Vasc Surg 2001;33:114-22.
- 60.KNGF. Richtlijn Asymptomatisch Perifeer Arterieel Vaatlijden. Nederlands Tijdschrift voor Fysiotherapie. In press.
- 61.Koelemay MJ, Den Hartog D, Prins MH, Kromhout JG, Legemate DA, Jacobs MJ. Diagnosis of arterial disease of the lower extremities with duplex ultrasonography. Br J Surg 1996;83:404-9.
- 62.Kroger K, Stang A, Kondratieva J, Moebus S, Beck E, Schmermund A, et al. Prevalence of peripheral arterial disease - results of the Heinz Nixdorf recall study. Eur J Epidemiol 2006;21:279-85.
- 63.Kruidenier LM, Viechtbauer W, Nicolai SP, Buller H, Prins MH, Teijink JA. Treatment for intermittent claudication and the effects on walking distance and quality of life. Vascular 2012;20:20-35.
- 64.Kullo IJ, Bailey KR, Kardia SL, Mosley TH, Jr., Boerwinkle E, Turner ST. Ethnic differences in peripheral arterial disease in the NHLBI Genetic Epidemiology Network of Arteriopathy (GENOA) study. Vasc Med 2003;8:237-42.
- 65.Lange SF, Trampisch HJ, Pittrow D, Darius H, Mahn M, Allenberg JR, et al. Profound influence of different methods for determination of the ankle brachial index on the prevalence estimate of peripheral arterial disease. BMC Public Health 2007;7:147.
- 66.Lawall H, Diehm C. Deutsche Gesellschaft für Angiologie Gesellschaft für Gefäßmedizin. Leitlinien zur Diagnostik und Therapie der peripheren arteriellen Verschlusskrankheit (PAVK) (2009). http://www.dga-gefaessmedizin.de/uploads/media/S3-LL_PAVK_27_4_09_def.pdf.
- 67.Leng GC, Fowkes FG, Lee AJ, Dunbar J, Housley E, Ruckley CV. Use of ankle brachial pressure index to predict cardiovascular events and death: a cohort study. BMJ 1996a;313:1440-4.
- 68.Leng GC, Lee AJ, Fowkes FG, Whiteman M, Dunbar J, Housley E, et al. Incidence, natural history and cardiovascular events in symptomatic and asymptomatic peripheral arterial disease in the general population. Int J Epidemiol 1996b;25:1172-81.
- 69.McDermott MM, Fried L, Simonsick E, Ling S, Guralnik JM. Asymptomatic peripheral arterial disease is independently associated with impaired lower extremity functioning: the women’s health and aging study. Circulation 2000;101:1007-12.
- 70.McDermott MM, Liu K, Ferrucci L, Tian L, Guralnik JM, Green D, et al. Circulating blood markers and functional impairment in peripheral arterial disease. J Am Geriatr Soc 2008;56:1504-10.
- 71.McDermott MM, Guralnik JM, Tian L, Liu K, Ferrucci L, Liao Y, et al. Associations of borderline and low normal ankle-brachial index values with functional decline at 5-year follow-up: the WALCS (Walking and Leg Circulation Study). J Am Coll Cardiol 2009;53:1056-62.
- 72.McDermott MM, Liu K, Ferrucci L, Tian L, Guralnik JM, Liao Y, et al. Greater sedentary hours and slower walking speed outside the home predict faster declines in functioning and adverse calf muscle changes in peripheral arterial disease. J Am Coll Cardiol 2011;57:2356-64.
- 73.McDermott MM, Ohlmiller SM, Liu K, Guralnik JM, Martin GJ, Pearce WH, et al. Gait alterations associated with walking impairment in people with peripheral arterial disease with and without intermittent claudication. J Am Geriatr Soc 2001;49:747-54.
- 74.McGee SR, Boyko EJ. Physical examination and chronic lower-extremity ischemia: a critical review. Arch Intern Med 1998;158:1357-64.
- 75.Meijer WT, Grobbee DE, Hunink MGM, Hofman A, Hoes AW. Determinants of peripheral arterial disease in the elderly: the Rotterdam study. Arch Intern Med 2000;160:2934-8.
- 76.Meijer WT, Hoes AW, Rutgers D, Bots ML, Hofman A, Grobbee DE. Peripheral arterial disease in the elderly: The Rotterdam Study. Arterioscler Thromb Vasc Biol 1998;18:185-92.
- 77.Moher D, Pham B, Ausejo M, Saenz A, Hood S, Barber GG. Pharmacological management of intermittent claudication: a meta-analysis of randomised trials. Drugs 2000;59:1057-70.
- 78.Murabito JM, D’Agostino RB, Silbershatz H, Wilson WF. Intermittent claudication. A risk profile from The Framingham Heart Study. Circulation 1997;96:44-9.
- 79.Ness J, Aronow WS. Prevalence of coronary artery disease, ischemic stroke, peripheral arterial disease, and coronary revascularization in older African-Americans, Asians, Hispanics, whites, men, and women. Am J Cardiol 1999;84:932-3, A7.
- 80.NICE. Lower Limb Peripheral Arterial Disease: diagnosis and management (2012). http://www.nice.org.uk/nicemedia/live/13856/60428/60428.pdf.
- 81.Nicolai SP, Kruidenier LM, Bendermacher BL, Prins MH, Teijink JA. Ginkgo biloba for intermittent claudication. Cochrane Database Syst Rev 2009a;CD006888.
- 82.Nicolai SP, Kruidenier LM, Rouwet EV, Bartelink ML, Prins MH, Teijink JA. Ankle brachial index measurement in primary care: are we doing it right? Br J Gen Pract 2009b;59:422-7.
- 83.Nicolai SP, Teijink JA, Prins MH. Multicenter randomized clinical trial of supervised exercise therapy with or without feedback versus walking advice for intermittent claudication. J Vasc Surg 2010;52:348-55.
- 84.Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007;33 Suppl 1:S1-75.
- 85.Ouriel K, McDonnell AE, Metz CE, Zarins CK. Critical evaluation of stress testing in the diagnosis of peripheral vascular disease. Surgery 1982;91:686-93.
- 86.Ouriel K. Peripheral arterial disease. Lancet 2001;358:1257-64.
- 87.Parr B, Noakes TD, Derman EW. Factors predicting walking intolerance in patients with peripheral arterial disease and intermittent claudication. S Afr Med J 2008;98:958-62.
- 88.Price J, Leng GC. Steroid sex hormones for lower limb atherosclerosis. Cochrane Database Syst Rev 2012;10:CD000188.
- 89.Price JF, Mowbray PI, Lee AJ, Rumley A, Lowe GD, Fowkes FG. Relationship between smoking and cardiovascular risk factors in the development of peripheral arterial disease and coronary artery disease: Edinburgh Artery Study. Eur Heart J 1999;20:344-53.
- 90.Radack K, Deck C. Beta-adrenergic blocker therapy does not worsen intermittent claudication in subjects with peripheral arterial disease. A meta-analysis of randomized controlled trials. Arch Intern Med 1991;151:1769-76.
- 91.Ridker PM, Stampfer MJ, Rifai N. Novel risk factors for systemic atherosclerosis: a comparison of C-reactive protein, fibrinogen, homocysteine, lipoprotein(a), and standard cholesterol screening as predictors of peripheral arterial disease. JAMA 2001;285:2481-5.
- 92.Robless P, Mikhailidis DP, Stansby GP. Cilostazol for peripheral arterial disease. Cochrane Database Syst Rev 2008;CD003748.
- 93.Rutgers D, Meijer WT. Prevalentie van perifere arteriele vaatziekte en claudication intermittens bij personen van 55 jaar en ouder: het ERGO-onderzoek. Ned Tijdschr Geneeskd 1998;142:2851-6.
- 94.Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM, Ahn S, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26:517-38.
- 95.Salhiyyah K, Senanayake E, Abdel-Hadi M, Booth A, Michaels JA. Pentoxifylline for intermittent claudication. Cochrane Database Syst Rev 2012;1:CD005262.
- 96.Sigvant B, Wiberg-Hedman K, Bergqvist D, Rolandsson O, Andersson B, Persson E, et al. A population-based study of peripheral arterial disease prevalence with special focus on critical limb ischemia and sex differences. J Vasc Surg 2007;45:1185-91.
- 97.Smith I, Franks PJ, Greenhalgh RM, Poulter NR, Powell JT. The influence of smoking cessation and hypertriglyceridaemia on the progression of peripheral arterial disease and the onset of critical ischaemia. Eur J Vasc Endovasc Surg 1996;11:402-8.
- 98.Spronk S, Bosch JL, Veen HF, Den Hoed PT, Hunink MG. Intermittent claudication: functional capacity and quality of life after exercise training or percutaneous transluminal angioplasty--systematic review. Radiology 2005;235:833-42.
- 99.Stewart KJ, Hiatt WR, Regensteiner JG, Hirsch AT. Exercise training for claudication. N Engl J Med 2002;347:1941-51.
- 100.Stoffers HEJH. Noninvasive vascular tests in general practice. A literature review. In: Peripheral arterial occlusive disease. Prevalence, and diagnostic management in general practice [proefschrift]. Maastricht: Universitaire Pers Maastricht, 1995.
- 101.Stoffers HE, Kester AD, Kaiser V, Rinkens PE, Knottnerus JA. Diagnostic value of signs and symptoms associated with peripheral arterial occlusive disease seen in general practice: a multivariable approach. Med Decis Making 1997;17:61-70.
- 102.Stoffers HE, Rinkens PE, Kester AD, Kaiser V, Knottnerus JA. The prevalence of asymptomatic and unrecognized peripheral arterial occlusive disease. Int J Epidemiol 1996a;25:282-90.
- 103.Stoffers HEJH, Kester ADM, Kaiser V, Rinkens PELM, Kitslaar PJEH, Knottnerus A. The diagnostic value of the measurement of the ankle-brachial systolic pressure index in primary health care. J Clin Epidemiol 1996b;49:1401.
- 104.Stoffers J. Peripheral arterial disease. In: Jones R, Britten N, Gulpepper L, Grass D, Grol R, Mant D et al., editors. Oxford textbook of primary medical care. Oxford: Oxford University Press, 2004: 631-7.
- 105.Szuba A, Oka RK, Harada R, Cooke JP. Limb hemodynamics are not predictive of functional capacity in patients with PAD. Vasc Med 2006;11:155-63.
- 106.Tendera M, Aboyans V, Bartelink ML, Baumgartner I, Clement D, Collet JP, et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011;32:2851-906.
- 107.Twine CP, Coulston J, Shandall A, McLain AD. Angioplasty versus stenting for superficial femoral artery lesions. Cochrane Database Syst Rev 2009;CD006767.
- 108.Twine CP, McLain AD. Graft type for femoro-popliteal bypass surgery. Cochrane Database Syst Rev 2010;CD001487.
- 109.Vahl AC, Reekers JA. Richtlijn ‘Diagnostiek en behandeling van arterieel vaatlijden van de onderste extremiteit’ van de Nederlandse Vereniging voor Heelkunde. Ned Tijdschr Geneeskd 2005;149:1670-4.
- 110.Van de Lisdonk EH, Van den Bosch WJHM, Lagro-Janssen ALM. Ziekten in de huisartspraktijk. 5de druk. Maarssen: Elsevier Gezondheidszorg, 2008.
- 111.Villarruz MV, Dans A, Tan F. Chelation therapy for atherosclerotic cardiovascular disease. Cochrane Database Syst Rev 2002;CD002785.
- 112.Vliegenthart R, Geleijnse JM, Hofman A, Meijer WT, Van Rooij FJ, Grobbee DE, et al. Alcohol consumption and risk of peripheral arterial disease: the Rotterdam study. Am J Epidemiol 2002;155:332-8.
- 113.Watson L, Ellis B, Leng GC. Exercise for intermittent claudication. Cochrane Database Syst Rev 2008;CD000990.
- 114.Willigendael EM, Teijink JA, Bartelink ML, Kuiken BW, Boiten J, Moll FL, et al. Influence of smoking on incidence and prevalence of peripheral arterial disease. J Vasc Surg 2004;40:1158-65.
- 115.Willigendael EM, Teijink JA, Bartelink ML, Peters RJ, Buller HR, Prins MH. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J Vasc Surg 2005;42:67-74.
- 116.Zheng ZJ, Rosamond WD, Chambless LE, Nieto FJ, Barnes RW, Hutchinson RG, et al. Lower extremity arterial disease assessed by ankle-brachial index in a middle-aged population of African Americans and whites: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Prev Med 2005;29:42-9.
Reacties
Er zijn nog geen reacties.