Belangrijkste wijzigingen
- De afkapwaarden voor (NT-pro)BNP bij acuut hartfalen verschillen van de afkapwaarden bij geleidelijk ontstaan hartfalen.
- Toegevoegd is een paragraaf over palliatieve zorg, multidisciplinaire ketenzorg en hartfalenzorgprogramma’s.
Kernboodschappen
- Deze NHG-Standaard is inhoudelijk gelijk aan de Multidisciplinaire richtlijn Hartfalen 2010.
- De diagnose hartfalen berust op kenmerkende symptomen én onderzoeksbevindingen passend bij hartfalen én objectief bewijs voor een structurele of functionele afwijking van het hart in rust.
- Een normaal ecg in combinatie met een normaal (NT-pro)BNP sluit de diagnose hartfalen nagenoeg uit.
- Als de diagnose hartfalen niet kan worden uitgesloten door een ecg en (NT-pro)BNP, moet altijd echocardiografie worden verricht, ter verdere diagnostiek dan wel om de oorzaak van hartfalen te achterhalen.
- Een praktische aanpak bij de medicamenteuze therapie van systolisch hartfalen is gelijktijdig starten van een diureticum en een ACE-remmer (of een AII-antagonist als ACE-remmers niet worden verdragen) waarna, als de patiënt klinisch stabiel is, een bètablokker wordt toegevoegd.
Inbreng van de patiënt
De NHG-Standaarden geven richtlijnen voor het handelen van de huisarts; de rol van de huisarts staat dan ook centraal. Daarbij geldt echter altijd dat factoren van de kant van de patiënt het beleid mede bepalen. Om praktische redenen komt dit uitgangspunt niet telkens opnieuw in de richtlijn aan de orde, maar wordt het hier expliciet vermeld. De huisarts stelt waar mogelijk zijn beleid vast in samenspraak met de patiënt, met inachtneming van diens specifieke omstandigheden en met erkenning van diens eigen verantwoordelijkheid, waarbij adequate voorlichting een voorwaarde is.
Afweging door de huisarts
Het persoonlijk inzicht van de huisarts is uiteraard bij alle richtlijnen een belangrijk aspect. Afweging van de relevante factoren in de concrete situatie zal beredeneerd afwijken van het hierna beschreven beleid kunnen rechtvaardigen. Dat laat onverlet dat deze standaard bedoeld is om te fungeren als maat en houvast.
Delegeren van taken
NHG-Standaarden bevatten richtlijnen voor huisartsen. Dit betekent niet dat de huisarts alle genoemde taken persoonlijk moet verrichten. Sommige taken kunnen worden gedelegeerd aan de praktijkassistente, praktijkondersteuner of praktijkverpleegkundige, mits zij worden ondersteund door duidelijke werkafspraken waarin wordt vastgelegd in welke situaties de huisarts moet worden geraadpleegd en mits de huisarts toeziet op de kwaliteit. Omdat de feitelijke keuze van de te delegeren taken sterk afhankelijk is van de lokale situatie, bevatten de standaarden daarvoor geen concrete aanbevelingen.
Inleiding
De NHG-Standaard Hartfalen geeft richtlijnen voor diagnostiek en behandeling van chronisch en acuut hartfalen. Deze tweede herziening vervangt de eerste herziening uit 2005. Acuut hartfalen wordt besproken in een aparte paragraaf. Deze NHG-Standaard is inhoudelijk gelijk aan de Multidisciplinaire richtlijn Hartfalen 2010.Noot 1 De Multidisciplinaire richtlijn Hartfalen is samengesteld door diverse disciplines, met inbegrip van huisartsen, en is door het NHG als volledige richtlijn geaccepteerd. In deze NHG-Standaard worden belangrijkste onderdelen voor de huisarts gepresenteerd. Voor uitgebreide achtergrondinformatie kunt u de Multidisciplinaire richtlijn Hartfalen raadplegen.
Achtergronden
Epidemiologie
In 2007 waren er in Nederland naar schatting 120.000 mensen met hartfalen.Noot 2 Deze prevalentiecijfers zijn onder andere afkomstig uit huisartsenregistraties, waar het patiënten betreft met de klinische diagnose hartfalen. De prevalentie stijgt sterk met de leeftijd, van 0,8% tussen de 55 en 64 jaar via 3% tussen de 65 en 74 jaar en 10% tussen de 75 en 84 jaar naar 20% voor mensen van 85 jaar en ouder. De voor leeftijd gecorrigeerde prevalentie is bij mannen hoger dan bij vrouwen. Onder relatief jonge patiënten met hartfalen zijn meer mannen en is coronarialijden de belangrijkste oorzaak. Omdat meer vrouwen dan mannen een hoge leeftijd halen, zijn er in de leeftijdsgroep ouder dan 75 jaar meer vrouwelijke patiënten met hartfalen. Op oudere leeftijd is de oorzaak voor hartfalen veelal langdurige hypertensie. Verwacht wordt dat de prevalentie van hartfalen verder zal toenemen door veroudering van de bevolking en dankzij de succesvolle behandeling van coronaire hartziekte. Per jaar komen er ongeveer 39.000 nieuwe patiënten met hartfalen bij; dat zijn er per gemiddelde huisartsenpraktijk van 2350 patiënten ongeveer 7.
Begrippen
Definitie van hartfalen
Hartfalen is een complex van klachten en verschijnselen bij een structurele of functionele afwijking van het hart (zie het kader ‘Hartfalen’) die leiden tot een tekortschietende pompfunctie van het hart. Centraal bij hartfalen staat een verminderde inspanningstolerantie, die zich uit in klachten van kortademigheid en/of vermoeidheid. Meestal zijn er ook tekenen van vochtretentie, zoals pulmonale crepitaties, perifeer oedeem en verhoogde centraalveneuze druk (CVD), of is een heffende/verbrede ictus palpabel in linkerzijligging. In ernstiger gevallen kunnen ook tachycardie en tachypneu worden vastgesteld. Bij twijfel kan een klinische verbetering na toediening van diuretica de diagnose ondersteunen. In vroege stadia van hartfalen kunnen verschijnselen van overvulling echter ontbreken. Zie voor andere klinische manifestaties van hartfalen noot 3.Noot 3
Hartfalen
De diagnose hartfalen berust op drie pijlers:
- klinische symptomen passend bij hartfalen (bijvoorbeeld verminderde inspanningstolerantie, zich veelal uitend in klachten van kortademigheid en vermoeidheid of perifeer oedeem);
- onderzoeksbevindingen passend bij hartfalen (bijvoorbeeld crepiteren over de longen, verhoogde centraalveneuze druk (CVD), perifeer oedeem, vergrote lever, heffende/verbrede ictus, hartgeruis, tachycardie, tachypneu, derde harttoon);
- objectief bewijs voor een structurele of functionele afwijking van het hart in rust.
Nieuw ontstaan hartfalen heeft betrekking op de eerste presentatie. Deze kan acuut of geleidelijk zijn. Patiënten op de spoedeisende hulp in het ziekenhuis behoren veelal tot de eerste groep, terwijl bij geleidelijk nieuw hartfalen vaak de eerste presentatie bij (verpleeg)huisarts, internist, cardioloog of geriater, is. Vastgesteld hartfalen kan tijdelijk of chronisch zijn. Tijdelijk hartfalen kan worden hersteld. Voorbeelden zijn de (sub)acute fase van een acuut coronair syndroom, reversibele cardiomyopathieën en behandelbare klepgebreken en ritme- of geleidingsstoornissen. Chronisch hartfalen is veelal langzaam progressief maar kan ook (tijdelijk) stabiel zijn en acuut exacerberen.
Presentatie van hartfalen
Nieuw hartfalen: acuut of geleidelijk ontstaan
Indeling van hartfalen
- Tijdelijk hartfalen: eenmalig of recidiverend.
- Chronisch hartfalen: stabiel, (langzaam) progressief, acuut exacerberend
Met behulp van echocardiografie kan hartfalen verder worden opgesplitst in hartfalen met systolische linkerventrikeldisfunctie (echografisch een linkerventrikelejectiefractie (LVEF) < 45%), een combinatie van systolische en diastolische linkerventrikeldisfunctie of alleen diastolische disfunctie. Geschat wordt dat in de huisartsenpraktijk van de patiënten met hartfalen 40-50% systolisch en 50-60% diastolisch hartfalen heeft. Vereenvoudigd weergegeven betreft het bij systolische disfunctie een hart dat door verschillende oorzaken onvoldoende samentrekt tijdens de systole. Een veel voorkomende oorzaak is een hartinfarct. Bij diastolische disfunctie is geen sprake van een (sterk) verminderde contractie van het hart, maar wordt het hartfalen veroorzaakt door een verstijving van het hart. Een veel voorkomende oorzaak is langdurige hypertensie. Andere descriptieve termen bij hartfalen, zoals ‘forward failure’ en ‘backward failure’, zijn van minder praktisch belang. De ernst van het hartfalen wordt weergegeven in de NYHA-classificatie (tabel 1).Noot 4
| Klasse I | geen beperking van het inspanningsvermogen; normale lichamelijke activiteit veroorzaakt geen overmatige vermoeidheid, palpitaties of dyspneu |
| Klasse II | enige beperking van het inspanningsvermogen; in rust geen klachten maar normale lichamelijke inspanning veroorzaakt overmatige vermoeidheid, palpitaties of dyspneu |
| Klasse III | ernstige beperking van het inspanningsvermogen; in rust geen of weinig klachten, maar lichte lichamelijke inspanning veroorzaakt overmatige vermoeidheid, palpitaties of dyspneu |
| Klasse IV | geen enkele lichamelijke inspanning mogelijk zonder klachten; ook klachten in rust |
Oorzaken van hartfalen
Er moet altijd naar de oorzaak voor het hartfalen worden gezocht. Bloedonderzoek, ecg en echocardiografie zijn hierbij nodig. De volgende mogelijke oorzaken of uitlokkende factoren zijn van belang en kunnen consequenties hebben voor het beleid: atriumfibrilleren, andere ritme- of geleidingsstoornissen, hartklepafwijkingen (vooral aortastenose en mitralisklepinsufficiëntie), hypertensie, ischemische hartziekte, medicatie (negatief inotrope medicatie zoals de niet-dihydropyridine calciumantagonisten verapamil en diltiazem, klasse-I-antiaritmica, middelen die kunnen leiden tot natrium- en vochtretentie (NSAID’s, COX-2-remmers, corticosteroïden), thiazolidinedionen, recente chemotherapie), intoxicaties (alcohol, cocaïne), anemie, exacerbatie van COPD, pneumonie, andere ernstige infecties, hyperthyreoïdie en longembolie. De meest voorkomende oorzaken zijn hypertensie en ischemische hartziekte. Oorzaken die op jonge leeftijd tot hartfalen leiden zijn zeldzaam.Noot 5
Prognose
De prognose bij hartfalen is zeer variabel en onder andere afhankelijk van de ernst, de etiologie, de leeftijd van de patiënt, comorbiditeit en de reeds gebleken snelheid van progressie. Het effect van behandeling op de prognose is op individueel niveau vaak moeilijk te voorspellen. De variabelen met de meeste prognostische waarde zijn vermeld in noot 6.Noot 6
Comorbiditeit
Er bestaat veel comorbiditeit bij hartfalen. Voor een deel zijn dit aandoeningen die bij ouderen veel voorkomen (epifenomenen), een ander deel houdt verband met hartfalen. De comorbiditeit bemoeilijkt de diagnostiek en heeft consequenties voor de prognose en therapie. Bij ouderen moet men rekening houden met polyfarmacie, kans op interacties en bijwerkingen en veranderende farmacokinetiek en -dynamiek. De belangrijkste vormen van comorbiditeit zijn de volgende.
Hypertensie
Hypertensie is een belangrijke oorzaak voor het ontstaan en in stand houden van hartfalen. Bloeddrukverlaging vermindert de drukbelasting voor de linker ventrikel en het cardiovasculaire risico. Bij alle patiënten met hartfalen wordt een streefwaarde < 130/80 mmHg aanbevolen.Noot 7
Diabetes mellitus
Diabetes is een belangrijke oorzaak voor het ontstaan van hartfalen door cardiovasculaire effecten, renale effecten en ‘diabetische cardiomyopathie’. Op de behandeling van diabetes is de NHG-Standaard Diabetes mellitus type 2 van toepassing. Thiazolidinedionen zijn gecontra-indiceerd bij patiënten met hartfalen.
Nierfunctiestoornis
Er bestaat een sterke verstrengeling tussen nier- en hartfunctie. Een verminderde glomerulaire filtratierate (GFR) komt vaker voor naarmate de leeftijd stijgt en er sprake is van hartfalen, hypertensie of diabetes mellitus. Er is bij hartfalen een sterk verband tussen nierinsufficiëntie, de ernst van het hartfalen, de morbiditeit en de mortaliteit.Noot 8 Aanpassing van de hartfalenmedicatie is bij een nierfunctiestoornis vaak noodzakelijk (zie de paragraaf Medicamenteuze behandeling). Bij nierfunctiestoornis (patiënten < 65 jaar, creatinineklaring < 45 ml/min.; patiënten > 65 jaar, creatinineklaring < 30 ml/min.) en bij macroalbuminurie kan verwijzing naar de nefroloog worden overwogen. Zie ook de Landelijke Transmurale Afspraak Chronische nierschade.
COPD
Hartfalen komt voor bij 27% van de mensen boven de 65 jaar met COPD. Dit is ongeveer driemaal zo vaak als men op grond van leeftijd alleen zou verwachten. Andersom is de prevalentie van COPD bij patiënten met hartfalen 20 tot 30%. COPD is een sterke en onafhankelijke risicofactor voor cardiovasculaire morbiditeit en mortaliteit. De diagnostiek van hartfalen is bemoeilijkt in aanwezigheid van COPD door overlap in klachten zoals kortademigheid en verminderde inspanningstolerantie, maar ook door overlap in de beoordeling van pulmonale bijgeluiden en bevindingen op ecg en thoraxfoto.Noot 9 Interpretatie van de echocardiografie kan bemoeilijkt zijn door de toegenomen luchthoudendheid van de thorax.
Anemie
Vooral anemie van chronische ziekte wordt vaak in combinatie met hartfalen gezien. Anemie kan hartfalen veroorzaken en verergeren door een negatief effect op de myocardfunctie en nierfunctie, door activering van neurohormonale systemen en doordat voor de doorbloeding van de weefsels een grotere cardiac output wordt gevraagd.Noot 10 Andersom kan hartfalen mede door effect op de nieren en het beenmerg anemie veroorzaken.
Depressie en angst
Depressie en angst zijn voor een deel toe te schrijven aan het chronisch progressieve karakter van hartfalen en de ernst van de aandoening. De prevalentie van depressies en angststoornissen onder patiënten met hartfalen is 20 tot 30%.Noot 11 De effectiviteit van medicamenteuze of gedragsmatige behandeling van depressie en angst bij deze patiënten is weinig onderzocht en nog niet vastgesteld. Voorzichtigheid is geboden met SSRI’s omdat geneesmiddeleninteractie met medicatie tegen hartfalen veel voorkomt en kan leiden tot hyponatriëmie en bloedingen.
Cognitieve stoornissen en hartfalen
Cognitieve stoornissen komen vaker voor bij mensen met hartfalen, en lijken toe te nemen met de ernst van het hartfalen. Vasculaire risicofactoren zoals hypertensie, diabetes mellitus en atriumfibrilleren zijn zowel risicofactor voor het ontwikkelen van hartfalen als voor cognitieve stoornissen en dementie. Ook verminderde cerebrale doorbloeding door hartfalen speelt een rol bij het ontwikkelen van cognitieve stoornissen en dementie. Bij patiënten van 85 jaar en ouder met hartfalen is er bij ruim 20% sprake van dementie.Noot 12
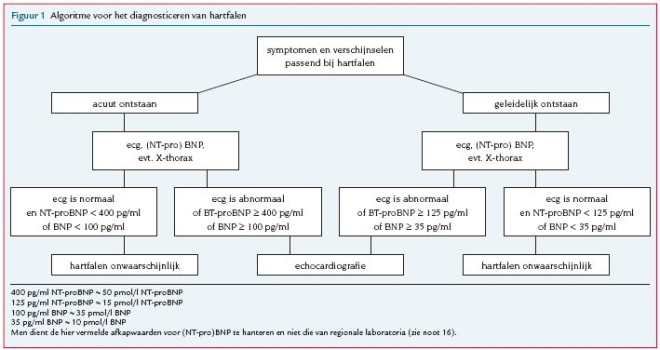
De eerste verdenking op hartfalen is gebaseerd op anamnese, aangevuld met informatie uit de voorgeschiedenis en het lichamelijk onderzoek. De anamnese en een zorgvuldig uitgevoerd lichamelijk onderzoek vormen de sleutel tot vroege opsporing van hartfalen.Noot 13 ,Noot 14 Kortademigheid en vermoeidheid als uiting van een verminderd inspanningsvermogen zijn kenmerkende klachten, maar zijn niet erg specifiek. Figuur 1 geeft een algoritme voor het diagnosticeren van hartfalen.
Anamnese
Informeer naar:
- verminderd inspanningsvermogen;
- kortademigheid: dyspneu bij inspanning of ook in rust, orthopneu, paroxismale nachtelijke dyspneu;
- vermoeidheid;
- mogelijke oorzaken of triggers voor hartfalen: angineuze klachten (ischemie), palpitaties, syncope als teken van ritme- of geleidingsstoornissen; gebruik van negatief inotrope middelen (de calciumantagonisten verapamil en diltiazem en klasse-I-antiaritmica zoals propafenon en flecaïnide), middelen die kunnen leiden tot natrium- en vochtretentie (NSAID’s, COX-2-remmers, corticosteroïden) en thiazolidinedionen.
Risicofactoren
Belaste familieanamnese voor cardiovasculaire aandoeningen, roken, overmatig alcoholgebruik, hyperlipidemie, hypertensie, diabetes en recente chemotherapie.
Voorgeschiedenis
Coronaire hartziekte (myocardinfarct, angina pectoris, coronaire bypassoperatie (CABG), percutane coronaire interventie (PCI), congenitale hartaandoening, hartkleplijden, cerebrovasculair accident (CVA), perifeer arterieel vaatlijden.
Lichamelijk onderzoek
- Algemeen. Voedingstoestand, lichaamsgewicht. Overgewicht belast het hart extra en cachexie is een prognostisch ongunstig teken.
- Pols. Frequentie (tachycardie of bradycardie?), ritme (regelmatig of onregelmatig?), kwaliteit.
- Bloeddruk. Systolisch, diastolisch, polsdruk. Bloeddrukmeting zowel zittend als staand om orthostatische hypotensie na te gaan.
- Overvulling? Verhoogde centraalveneuze druk, perifeer oedeem (enkels en sacrum), vergrote lever, ascites, pulmonale crepitaties, demping onderste longvelden passend bij pleuravocht. Overvulling van de longen kan ook leiden tot rhonchi en piepen.
- Ademfrequentie. (Tachypneu?).
- Hart. Ictus palpabel buiten de midclaviculairlijn in rugligging, of heffend/verbreed in linkerzijligging, derde harttoon (galopritme), hartgeruisen wijzend op klepafwijkingen.
Aanvullend onderzoek
Wanneer op grond van klachten en verschijnselen het vermoeden van hartfalen ontstaat, wordt aanvullend een ecg gemaakt en BNP of NT-proBNP bepaald.
- Een volstrekt normaal ecg heeft een grote negatief voorspellende waarde en maakt de diagnose hartfalen onwaarschijnlijk ([[vn:3532]] ,Noot 16 Een abnormaal ecg heeft een geringe positief voorspellende waarde voor de diagnose hartfalen.
- Een BNP- of NT-proBNP-waarde beneden het afkappunt (zie figuur 1) maakt de diagnose hartfalen onwaarschijnlijk (
- Een normaal ecg in combinatie met een normaal (NT-pro)BNP maakt de diagnose hartfalen zeer onwaarschijnlijk.
- Bij een verhoogd (NT-pro)BNP is nader onderzoek geïndiceerd, in de vorm van aanvullend laboratoriumonderzoek, echocardiografie en eventueel een thoraxfoto.Noot 17 Noot 18 Noot 19 Aanvullend onderzoek dient ter bevestiging of uitsluiting van de diagnose hartfalen en om de oorzaak te bepalen. Een echocardiogram is moeilijk te interpreteren. Aanbevolen wordt het echocardiogram te laten interpreteren door de cardioloog.
Voorlichting en leefstijlinterventies
Voorlichting over de aandoening en het belang van de behandeling zijn nodig om de patiënt in staat te stellen adequaat om te gaan met zijn ziekte. Zelfzorg is een belangrijk onderdeel van een succesvolle behandeling van hartfalen, levert bij patiënten met hartfalen een belangrijke bijdrage aan de kwaliteit van leven en kan de prognose verbeteren. Van belang zijn het behoud van een zo goed mogelijke lichamelijke conditie, vermijding van gedrag dat de ziekte nadelig beïnvloedt, bijtijds opmerken van symptomen van verslechtering en therapietrouw.Noot 21 Patiëntenvoorlichting dient over langere tijd en bij herhaling plaats te vinden. Een actieve betrokkenheid van de patiënt (en van familie of mantelzorgers) is een voorwaarde, evenals het hebben van voldoende kennis en vaardigheden om beslissingen te nemen. De belangrijkste aspecten die bij de voorlichting van patiënten met hartfalen aan de orde moeten komen, zijn de volgende.Noot 22 Zelfmedicatie. Vermijd bij hartfalen zoveel mogelijk het gebruik van NSAID’s. Flexibel diureticabeleid. Het aanpassen van de dosering diuretica binnen een tevoren afgesproken dosisgebied, op basis van de klachten en van eventuele bekende of voorspelbare situaties (meer diuretica bij snel toegenomen lichaamsgewicht of overmatige natriuminname; minder diuretica bij diarree of braken, koorts en warm weer) kan als zelfzorg worden aanbevolen indien de patiënt voldoende kennis van de aandoening heeft. De dosisaanpassing is meestal kortdurend nodig, afhankelijk van het kunnen wegnemen van de ‘trigger’ die voor ontregeling heeft gezorgd. Bewaking van het lichaamsgewicht. De patiënt moet dagelijks gewogen worden (of zichzelf wegen), bij voorkeur ’s morgens na het opstaan. Bij een gewichtstoename van 2 kg of meer in drie dagen mag de patiënt zelf zijn diureticumdosis tijdelijk verhogen of moet hij contact opnemen met de behandelaar. Natriumbeperking. Adviseer enige mate van natriumbeperking bij hartfalen; raad de patiënt aan piekinnames te vermijden.Noot 23 Vochtinname. Overweeg vochtbeperking van 1,5 à 2 liter per dag bij patiënten met ernstig hartfalen (NYHA-klasse III en IV), in het bijzonder bij hypervolemische hyponatriëmie;Noot 24 Meervoudig onverzadigde vetzuren. Bij patiënten met zowel systolisch als diastolisch hartfalen kan toevoeging van omega-3-vetzuren (1 g per dag) aan de standaardbehandeling worden overwogen, omdat dit de kans op sterfte en cardiovasculaire ziekenhuisopnames verkleint.Noot 25 Alcohol. Beperk de alcoholinname tot 1 à 2 eenheden per dag. Bij alcoholgeïnduceerde cardiomyopathie wordt totale abstinentie aangeraden.Noot 26 Gewichtsreductie. Moet worden overwogen bij patiënten met obesitas (BMI > 30 kg/m2).Noot 27 Onbedoeld gewichtverlies. Schenk in geval van cachexie (onbedoeld gewichtsverlies in de laatste zes tot twaalf maanden van meer dan 6% van het uitgangsgewicht na correctie voor over- en onderhydratie), aandacht aan de voedingstoestand van de patiënt;Noot 28 Roken. Adviseer het roken te staken. Vaccinatie. Adviseer de jaarlijkse griepvaccinatie. Lichaamsbeweging en conditietraining. Adviseer conditietraining aan alle patiënten met stabiel chronisch hartfalen.Noot 29 Seksuele activiteit. Is in het algemeen goed mogelijk, met een voorbehoud voor patiënten in NYHA-klasse III of IV.Noot 30 Reizen. Patiënten met hartfalen kunnen per vliegtuig reizen. Verblijf op grote hoogte (kortdurend > 2000 m en langerdurend > 1500 m) en reizen naar zeer warme en vochtige gebieden moet worden ontraden aan niet geheel klachtenvrije patiënten.Noot 31 Slaapstoornissen. Bij hartfalen komt slaapapneu vaak voor. Omdat de behandeling de morbiditeit verlaagt, kan slaaponderzoek worden overwogen;Noot 32 Autorijden. Patiënten in NYHA-klasse IV (klachten in rust) zijn in principe ongeschikt voor het besturen van een auto.Noot 33
In aansluiting op de gegeven mondelinge voorlichting kunt u de patiënt de NHG-Patiëntenbrieven Aanpak van hartfalen, Hartfalen algemeen en Voeding bij hartfalen meegeven. Deze brieven zijn gebaseerd op de NHG-Standaard Hartfalen. Zie voor een overzicht de NHG-website www.nhg.org, rubriek patiëntenvoorlichting.
Medicamenteuze behandeling
De hoofddoelen van de behandeling van hartfalen zijn:
- het reduceren van mortaliteit;
- het reduceren van het risico op ziekenhuisopname voor hartfalen;
- het verbeteren van klachten en kwaliteit van leven.
Behandeling van systolisch hartfalen
Een praktische aanpak is tegelijkertijd te beginnen met een diureticum en een ACE-remmer (of een AII-antagonist indien ACE-remmers niet worden verdragen). Indien de patiënt klinisch stabiel is (geen duidelijke klinische tekenen van overvulling heeft), moet een bètablokker in lage dosering worden toegevoegd. Vervolgens worden ACE-remmer en bètablokker verder opgetitreerd tot de streefdosis, of tot de maximale dosis die wordt verdragen zonder bijwerkingen. Voor een schematische weergave van de medicamenteuze therapie zie het kader Medicamenteuze behandeling van systolisch hartfalen. Start- en streefdoseringen en controles zijn weergegeven in tabel 2.
Medicamenteuze behandeling van systolisch hartfalen
| * | Start bij een hartfalenpatiënt in NYHA-klasse II-IV met zowel een diureticum als een ACE-remmer en titreer de dosis tot de patiënt klinisch stabiel is. |
| * | Voeg bij klinisch stabiele patiënt (geen overvulling) altijd een bètablokker toe en titreer de dosis van de ACE-remmer en de bètablokker stapsgewijs naar de streefdosis of naar de maximale dosis die wordt verdragen. |
| Iedere patiënt met systolisch hartfalen dient bovenstaande therapie te krijgen, tenzij er sprake is van contra-indicaties. | |
| ** | Voeg een aldosteronantagonist toe aan patiënten die ondanks adequate instelling op een ACE-remmer, diureticum en bètablokker ernstige klachten (NYHA-klasse III-IV) houden. |
| of: | |
| Aan deze patiënten kan een AII-antagonist worden voorgeschreven als alternatief voor behandeling met een aldosteronantagonist. | |
| *** | Overweeg toevoeging van digoxine bij patiënten met atriumfibrilleren bij wie ondanks een bètablokker de ventrikelfrequentie in rust > 80/min. of bij inspanning > 110-120/min. blijft. |
| Overweeg toevoeging van digoxine bij patiënten met sinusritme die klachten houden ondanks behandeling met een ACE-remmer, diureticum, bètablokker en aldosteronantagonist of AII-antagonist. |
ACE-remmers
Indicatie
Angiotensineconverterendenzymremmers worden gegeven aan alle patiënten met systolisch hartfalen.Noot 34 Bij patiënten met geleidelijk ontstaan nieuw hartfalen en tekenen van vochtretentie wordt gestart met een combinatie van een ACE-remmer en een diureticum.
Contra-indicaties
- Angio-oedeem in de voorgeschiedenis.
- Tweezijdige nierarteriestenose.
- Aortaklepstenose; hierbij kan ernstige hypotensie optreden.
- Uitgangswaarde van het serumkalium > 5 mmol/l.
- Creatinineklaring < 10 ml/min. (dosisaanpassing bij < 30 ml/min.).
- Zwangerschap.
Bijwerkingen
- Nierfunctieverslechtering: enige daling van de creatinineklaring na de start met ACE-remmers kan als normaal worden beschouwd. Ontraad het gebruik van NSAID’s. Daling van de creatinineklaring met 50% van de uitgangswaarde en daling tot een klaring van 30 ml/min. zijn nog acceptabel. Bij een creatinineklaring (GFR) tussen de 30 en 15 ml/min. wordt dosishalvering geadviseerd. Bij een daling onder de 15 ml/min. dient de ACE-remmer te worden gestaakt. Bij aanhoudende lage waarde van de creatinineklaring (
- Hyperkaliëmie: ga na of andere kaliumsparende diuretica (triamtereen, amiloride) worden voorgeschreven. Natriumarme voeding en zoutvervangers kunnen zeer kaliumrijk zijn. Een serumkaliumstijging tot 5,5 mmol/l door de ACE-remmer is acceptabel. Bij serumkalium > 5,5 mmol/l: halveer de dosis ACE-remmer en controleer het serumkalium. Bij serumkalium > 6,0 mmol/l: stop de ACE-remmer direct en controleer het serumkalium.
- Symptomatische (orthostatische) hypotensie (duizeligheid, collapsneiging bij overgang liggen-zitten-staan): indien een patiënt bij het starten van een ACE-remmer al een diureticum gebruikt, bestaat de kans op ‘first dose’-hypotensie. Deze kans is groter in geval van volumedepletie of hyponatriëmie. Het kan daarom nodig zijn om tijdelijk de dosis van het diureticum te verlagen.
- Hoest: hinderlijke hoest als bijwerking van een ACE-remmer is een reden om over te schakelen op een AII-antagonist.
Diuretica
Indicatie
Diuretica zijn geïndiceerd bij patiënten met hartfalen en klinische tekenen van vochtretentie.Noot 35 Geadviseerd wordt om bij patiënten met geleidelijk ontstaan nieuw hartfalen met tekenen van vochtretentie te starten met een combinatie van een ACE-remmer en een diureticum. Lisdiuretica hebben de voorkeur boven thiazidediuretica. Thiazidediuretica kunnen worden overwogen bij (zeer) geringe overvulling en bij mannen met benigne prostaathypertrofie. Combinatie van een lisdiureticum met een thiazide is effectief bij onvoldoende respons op het lisdiureticum alleen (diureticaresistentie). Andere mogelijke interventies bij diureticaresistentie zijn: furosemide vervangen door bumetanide, een aldosteronantagonist toevoegen, kortdurend parenteraal furosemide toedienen. Geef geen thiazide bij een creatineklaring < 30ml/min., uitgezonderd de synergistische toepassing in combinatie met een lisdiureticum om diureticaresistentie te doorbreken.
Bijwerkingen
- Hypokaliëmie/hypomagnesiëmie: verhoog de dosering ACE-remmer of AII-antagonist, voeg aldosteronantagonist toe en eventueel kalium- en magnesiumsupplementen. Hypokaliëmie gaat hand in hand met hypomagnesiëmie maar treedt eerder op, zodat bij laboratoriumcontroles bepaling van het serumkaliumgehalte volstaat.
- Normo- of hypovolemische hyponatriëmie: verlaag de dosis of stop het diureticum zo mogelijk, zo nodig vochtbeperking, eventueel tijdelijk natriumsuppletie.
- Hyperuricemie en jicht.
- Hypovolemie/dehydratie.
Bètablokkers
Indicatie
Bètablokkers zijn geïndiceerd bij patiënten met systolisch hartfalen, tenzij er sprake is van specifieke contra-indicaties.Noot 36 Om met bètablokkers te starten dient de patiënt klinisch stabiel te zijn en eerst ingesteld op een optimale dosis ACE-remmer en/of AII-antagonist, en geen klinische tekenen van overvulling te hebben. Bij exacerberend hartfalen kan tijdelijke dosisreductie van bètablokkers nodig zijn. Stoppen moet zoveel mogelijk vermeden worden, mede ook gezien de reflextachycardie die daardoor ontstaat.
Contra-indicaties
- Tweede- of derdegraads atrioventriculair blok.
- ‘Sick sinus syndrome’ zonder pacemaker.
- Sinusbradycardie (
- COPD is geen contra-indicatie en de meeste mensen met astma verdragen ook goed (cardioselectieve) bètablokkers.
Bijwerkingen
- Symptomatische hypotensie: verbetert vaak spontaan na enige tijd. Overweeg dosisverlaging van andere bloeddrukverlagende medicatie, behalve van ACE-remmers en AII-antagonisten. Te denken valt aan diuretica en nitraten.
- Klinische verslechtering van hartfalen: verhoog de dosering diuretica. Continueer zo mogelijk de bètablokker, eventueel in een lagere dosis.
- Bradycardie: maak een ecg om een atrioventriculair blok uit te sluiten. Overweeg eventueel digoxinegebruik te stoppen. Staken van de bètablokker kan nodig zijn.
Aldosteronantagonisten
Indicatie
Aldosteronantagonisten worden gegeven aan patiënten met systolisch hartfalen die ondanks adequate instelling op een ACE-remmer, diureticum en bètablokker nog ernstige klachten hebben (NYHA-klasse III-IV). Noot 37
Contra-indicaties
- Uitgangswaarde van de serumkaliumconcentratie > 5 mmol/l.
- Creatinineklaring < 10 ml/min.
- Gelijktijdig gebruik van kaliumsparende diuretica of kaliumsupplementen.
- Gecombineerde behandeling met een ACE-remmer en een AII-antagonist.
Bijwerkingen
- Hyperkaliëmie: indien het kalium stijgt tot > 5,5 mmol/l, moet de dosering worden gehalveerd. Bij kalium > 6,0 mmol/l moet de aldosteronantagonist worden gestaakt, het kalium frequent worden gecontroleerd en zo nodig worden gestart met specifieke therapie voor hyperkaliëmie.
- Nierfunctieverslechtering: bij een daling van de creatinineklaring onder de 45 ml/min. moet de dosering worden gehalveerd. Onder de 15 ml/min. moet de aldosteronantagonist direct worden gestaakt en zo nodig worden gestart met specifieke therapie voor nierinsufficiëntie.
- Pijnlijke borsten of gynaecomastie: kan optreden bij mannen door oestrogeenagonistische werking. Vervang spironolacton zo nodig door eplerenon.
AII-antagonisten
Indicatie
Angiotensine-II-receptorblokkers kunnen worden overwogen bij patiënten met systolisch hartfalen die met optimale behandeling met ACE-remmers, diuretica en bètablokkers niet klachtenvrij zijn (NYHA-klasse II-IV), als alternatief voor behandeling met een aldosteronantagonist.Noot 38 AII-antagonisten worden gegeven in plaats van ACE-remmers aan patiënten die hinderlijke bijwerkingen ondervinden van ACE-remmers.
Contra-indicaties
- Als bij ACE-remmers, behalve angio-oedeem.
- Patiënten die combinatietherapie krijgen met een ACE-remmer en een aldosteronantagonist.
- Ernstig gestoorde nierfunctie en verhoogd serumkalium.
- Bij aortaklepstenose kan ernstige hypotensie optreden.
Bijwerkingen
AII-antagonisten veroorzaken ongeveer even vaak als ACE-remmers nierfunctieverslechtering, hyperkaliëmie en hypotensie. Hoest komt weinig voor als bijwerking van AII-antagonisten.
Digoxine
Indicatie
Bij patiënten met systolisch hartfalen en atriumfibrilleren, bij wie ondanks een bètablokker de ventrikelfrequentie in rust > 80/min. of bij inspanning > 110-120/min. blijft, kan digoxine worden toegevoegd. Zie verder noot 39 en de NHG-Standaard Atriumfibrilleren. Bij patiënten met sinusritme en systolisch hartfalen kan behandeling met digoxine worden overwogen als de patiënt symptomatisch blijft ondanks behandeling met een ACE-remmer, diureticum, bètablokker en een AII-antagonist of aldosteronantagonist.Noot 39
Contra-indicaties
- Tweede- of derdegraads atrioventriculair blok zonder pacemaker; voorzichtigheid is geboden bij verdenking op ‘sick sinus syndrome’.
- Hyper- of hypokaliëmie.
Bijwerkingen
- Sinoatriaal en AV-blok.
- Zowel supraventriculaire als ventriculaire aritmieën komen voor.
- Symptomen van digoxine-intoxicatie zijn verwardheid, misselijkheid, eetlustverlies en gestoord kleurenzien.
| Medicament | Startdosis | Streefdosis/onderhoudsdosis |
|---|---|---|
| captopril | 6,25 mg 3dd | 50-100 mg 3dd |
| enalapril | 2,5 mg 2dd | 10-20 mg 2dd |
| lisinopril | 2,5-5 mg 1dd | 20-35 mg 1dd |
| ramipril | 2,5 mg 1dd | 5 mg 2dd |
| trandolapril | 0,5 mg 1dd | 4 mg 1dd |
| Controleer nierfunctie en serumelektrolyten bij start van de behandeling en 1-2 weken na de start van de behandeling. Optitratie van de dosis dient elke 2-4 weken in overweging genomen te worden. Bij een sterk teruglopende nierfunctie (> 50% daling creatinineklaring of creatinineklaring < 30/ml/min.) of een serumkalium > 5 mmol/l wordt verdere dosisverhoging uitgesteld. De nierfunctie en serumelektrolyten dienen 2-4 weken na elke dosisverdubbeling te worden gecontroleerd. Snellere dosisoptitratie kan, mits onder strenge monitoringcondities. Streef naar een onderhoudsdosis die overeenkomt met de evidence-based streefdosis of de maximaal getolereerde dosis. De nierfunctie en serumelektrolyten dienen 1, 2, 3 en 6 maanden na het bereiken van de onderhoudsdosis te worden gecontroleerd en daarna elke 6 maanden. | ||
| Lisdiuretica | ||
| furosemide | 20-40 mg | 40-240 mg |
| bumetanide | 0,5-1,0 mg | 1-5 mg |
| hydrochloorthiazide | 25 mg | 12,5-100 mg |
| chloortalidon | 25 mg | 12,5-50 mg |
| Start met een lage dosis (meestal wordt de voorkeur gegeven aan lisdiureticuma boven thiazide) en verhoog deze totdat klinische verbetering van de vochtretentie optreedt. Bij patiënten met een verminderde nierfunctie is een hogere dosis nodig. De dosis dient te worden verlaagd nadat de patiënt voldoende ontwaterd is, om de kans op dehydratie en nierfunctievermindering klein te houden. Houd de onderhoudsdosis diuretica zo laag mogelijk. Bij optimale instelling op ACE-remmers en bètablokkers kan vaak worden volstaan met een lage dosis diuretica of zelfs met intermitterend gebruik op geleide van de eerste tekenen van vochtretentie. Dagelijks wegen en voorlichting over verschijnselen van vochtretentie en flexibele zelfdosering van diuretica kunnen patiënten in staat stellen om hun diureticadosis zo laag mogelijk te houden maar tevens, zo nodig, snel op te hogen. Controleer regelmatig serumelektrolyten en creatinineklaring. Waakzaamheid is geboden vanwege de risico’s op hypovolemie, hypokaliëmie en hyponatriëmie. Volumedepletie en hyponatriëmie door te hoge dosering van diuretica kunnen het risico van (orthostatische) hypotensie en nierfunctiestoornissen vergroten. | ||
| bisoprolol | 1,25 mg 1dd | 10 mg 1dd |
| carvedilol | 3,125 mg 2dd | 25-50 mg 2dd |
| metoprololsuccinaat met vertraagde afgifte | 12,5/25 mg 1dd | 200 mg 1dd |
| nebivolol | 1,25 mg 1dd | 10 mg 1dd |
| Dosisoptitratie elke 2-4 weken; bij sommige patiënten is een langzamer tempo van optitreren nodig omdat bètablokkers soms in de beginfase van de therapie tijdelijk een verergering van de klachten kunnen geven. Dosisoptitratie dient dan ook langzaam en gecontroleerd plaats te vinden. Verhoog de dosis niet als er tekenen zijn van exacerberend hartfalen (meer vochtretentie), symptomatische hypotensie (bijvoorbeeld duizeligheid bij opstaan) of bradycardie ( | ||
| spironolacton | 25 mg 1dd | 25 mg (bij progressief hartfalen evt. 50 mg 1dd) |
| eplerenon | 25 mg 1dd | 50 mg 1dd |
| Controleer nierfunctie en serumelektrolyten bij start van de behandeling en 1 en 4 weken na start van de behandeling. Extra controles van serumkalium bij een klaring van 10-50 ml/min. Overweeg na 4-8 weken verhoging van de dosis tot 50 mg 1dd alleen bij progressief hartfalen als de nierfunctie niet verslechtert en het kalium < 5 mmol/l blijft. Controleer de nierfunctie en serumelektrolyten na de dosisverhoging na 1 en 4 weken. Streef naar de evidence-based onderhoudsdosis mits nierfunctie en sereumelektrolyten normaal blijven. Controleer nierfunctie en serumelektrolyten na 1, 2, 3 en 6 maanden en verder elke 6 maanden na het instellen op de onderhoudsdosis. | ||
| candesartan | 4 of 8 mg 1dd | 32 mg 1dd |
| valsartan | 40 mg 2dd | 160 mg 2dd |
| Controleer nierfunctie en serumelektrolyten bij start van de behandeling en 1 en 2 weken na de start van de behandeling. Overweeg dosis te verhogen na 2-4 weken als de nierfunctie niet verslechtert en geen hyperkaliëmie ontstaat; controleer dit 1 en 2 weken na dosisverhoging. Streef naar een evidence-based onderhoudsdosis of naar de maximaal getolereerde dosis. Controleer nierfunctie en serumelektrolyten na 1, 2, 3 en 6 maanden en verder elke 6 maanden na het instellen op de onderhoudsdosis. | ||
| Een oplaaddosis digoxine is niet zinvol bij stabiele patiënten met een sinusritme. De gebruikelijke onderhoudsdosis bij een normale nierfunctie is 0,25 mg 1dd. Bij ouderen en bij verminderde nierfunctie wordt een lagere dosis van 0,125 mg of 0,0625 mg 1dd aanbevolen. | ||
| Bepaal bij verdenking op digoxine-intoxicatie de digoxinespiegel (de therapeutische serumdigoxineconcentratie is 0,6-1,2 nmol/l). |
Behandeling van diastolisch hartfalen
Een gecombineerde systolische en diastolische disfunctie wordt behandeld zoals beschreven onder Behandeling van systolisch hartfalen. Van geen enkele behandeling is tot op heden overtuigend aangetoond dat deze de morbiditeit en mortaliteit bij patiënten met diastolisch hartfalen vermindert.Noot 41 Het volgende beleid wordt aanbevolen:
- diuretica indien er sprake is van vochtretentie;
- adequate behandeling van hypertensie (er is geen afdoende bewijs dat een bepaald antihypertensivum de voorkeur verdient);
- adequate vermindering van de hartfrequentie bij een tachycardie;
- bijkomende morbiditeit (myocardinfarct) wordt behandeld conform de desbetreffende richtlijnen.
Overige medicamenteuze behandeling bij hartfalen
Orale anticoagulantia (cumarines)
Patiënten met hartfalen en atriumfibrilleren komen in aanmerking voor behandeling met cumarines dan wel een plaatjesaggregatieremmer (zie noot 42). Dit is conform de adviezen in de NHG-Standaard Atriumfibrilleren.Noot 42
Statines
Hartfalen is geen reden voor start van een cholesterolsyntheseremmer (statine). Indien patiënten met hartfalen een statine gebruiken voor een andere indicatie wordt deze behandeling voortgezet.Noot 43
Calciumantagonisten
Calciumantagonisten die als antihypertensivum worden voorgeschreven dienen bij systolisch hartfalen te worden vervangen door bijvoorbeeld ACE-remmers, AII-antagonisten of bètablokkers. Wanneer met deze middelen onvoldoende controle van bloeddruk of angina pectoris wordt bereikt, kunnen zo nodig alleen langwerkende dihydropyridines veilig worden toegepast.
Controles
Bij alle patiënten met hartfalen zijn frequente controles noodzakelijk. De frequentie is afhankelijk van de individuele situatie. Na elke verandering in de medicatie, bijvoorbeeld in de optitreerfase, is het wenselijk de patiënt op korte termijn terug te zien. De werkgroep adviseert om patiënten met hartfalen die eenmaal medicamenteus goed ingesteld zijn, eenmaal per drie maanden te controleren. Besteed tijdens deze controles vooral aandacht aan het inspanningsvermogen en vraag naar eventuele bijwerkingen van de medicatie. Lichamelijk onderzoek bestaat minstens uit het meten van de bloeddruk (zittend en staand), het voelen van de pols en wegen. Aanvullend onderzoek is nodig bij een afwijkend beloop van de klachten. Klachten kunnen over de tijd variëren, er is niet altijd een oorzaak voor aan te tonen. Besteed bij toename van klachten of symptomen in kortere tijd bij patiënten met onderhoudsmedicatie aandacht aan uitlokkende factoren zoals infecties, NSAID-gebruik, extra zout of onjuist toepassen van de therapie. De patiënt krijgt zo nodig nogmaals uitleg over de aard van de aandoening en het belang van therapietrouw. Vraag of de patiënt de voorgeschreven medicatie inneemt, benadruk het belang van de behandeling en het juiste gebruik van de voorgeschreven medicatie.
Devices, percutane behandeling en chirurgie
Aandoeningen (coronaire hartziekte, hartklepgebreken, ritme- en geleidingsstoornissen) die de oorzaak zijn van het hartfalen en die door percutane of chirurgische behandeling of met behulp van devices gecorrigeerd kunnen worden, moeten worden opgespoord en behandeld indien de voordelen van de behandeling opwegen tegen de kans op complicaties ten gevolge daarvan.Noot 44 Zulke aandoeningen kunnen zich ook ontwikkelen bij het voortschrijden van het hartfalen. Daarom zijn naast de driemaandelijkse controles ook regelmatige (jaarlijkse) herhalingen van ecg en echocardiografie nodig, en eerder bij onverklaarde snelle achteruitgang van het hartfalen, collaps en aanwijzingen voor brady- of tachycardieën. Indien bij iemand met systolisch hartfalen en optimale therapie op het ecg een QRS > 120 ms ontstaat en er geen sprake is van atriumfibrilleren, moet cardiale resynchronisatietherapie (CRT) worden overwogen, en bij een LVEF < 35% een intracardiale defibrillator (ICD). Beide devices kunnen gecombineerd gebruikt worden (CRT-D). Voor meer gedetailleerde informatie over mogelijke interventies wordt verwezen naar de Multidisciplinaire richtlijn Hartfalen 2010.1
Ritmestoornissen bij hartfalen
Atriumfibrilleren
Atriumfibrilleren is de meest voorkomende ritmestoornis bij hartfalen en kan zowel oorzaak als gevolg zijn van hartfalen. Uitlokkende factoren en comorbiditeit moeten worden opgespoord en indien mogelijk gecorrigeerd (bijvoorbeeld elektrolytstoornissen, hyperthyreoïdie, alcoholgebruik, mitralisklepafwijking, acute ischemie, acute pulmonale aandoening, infectie, ongecontroleerde hypertensie). Zie ook de NHG-Standaard Atriumfibrilleren.
Consultatie en verwijzing
Het heeft de voorkeur om voor consultatie en verwijzing samen te werken met cardiologen met wie een uitgewerkte samenwerkingsrelatie bestaat, zodanig dat de huisartsenzorg aansluit bij de specialistische zorg. Zie ook de paragraaf Multidisciplinaire ‘ketenzorg’ en hartfalenprogramma’s. Consultatie van of verwijzing naar een cardioloog voor diagnostiek en (een) behandeling(sadvies) is geïndiceerd in de volgende gevallen:
- bij twijfel over de diagnose hartfalen;
- voor het verrichten en interpreteren van echocardiografie;
- bij onvoldoende verbetering op ingestelde medicamenteuze therapie of bij abrupte verslechtering;
- bij hartfalen ten gevolge van mogelijk corrigeerbare afwijkingen, zoals kleplijden of een ritme- of geleidingsstoornis waarbij een indicatie zou kunnen bestaan voor chirurgie of devices;
- bij vermoeden van een recent myocardinfarct;
- als de patiënt naast hartfalen ook angina pectoris heeft en/of ST-T-afwijkingen op het ecg die passen bij ischemie, en de algehele conditie een eventuele PCI of CABG als behandeloptie toelaat;
- bij relatief jonge patiënten;
- bij verdenking op cardiomyopathie;
- als bij systolisch hartfalen de ejectiefractie < 35% is bij patiënten die klachten houden ondanks optimale therapie met drie middelen (diuretica, ACE-remmers en bètablokkers) om te beoordelen of ICD zinvol is;
- bij systolisch hartfalen bij patiënten die klachten houden ondanks optimale therapie met vier middelen (diuretica, ACE-remmers, bètablokkers en aldosteronantagonisten of AII-antagonisten) en een verbreed QRS-complex (> 120 msec) om te beoordelen of cardiale resynchronisatietherapie (CRT) zinvol is.
Acuut hartfalen
Definitie
Acuut hartfalen is gedefinieerd als een snel begin of een snelle toename van verschijnselen van hartfalen, waarbij behandeling spoedeisend is. Het kan gaan om een eerste presentatie van hartfalen of om verergering van bestaand chronisch hartfalen. Er is sprake van een acute stressreactie van het lichaam met hoge spiegels (nor)adrenaline. Bij acuut hartfalen staat longstuwing meestal op de voorgrond, hoewel bij sommige patiënten een verminderde cardiac output en weefselhypoperfusie het klinisch beeld kunnen bepalen.Noot 45 Ernstig acuut hartfalen kan leiden tot ‘multi-organ failure’. Bij adequate behandeling in de acute fase moet ook de onderliggende pathologie worden betrokken. Oorzaken van acuut hartfalen kunnen zijn: ischemie inclusief een acuut myocardinfarct, hartritmestoornissen, klepdisfunctie, pericardaandoeningen, verhoogde vullingsdrukken of een verhoogde perifere weerstand. Vaak is er sprake van combinaties van deze oorzaken.Noot 46 Ook infecties, anemie, thyreotoxicose, slechte therapietrouw, gebruik van geneesmiddelen zoals NSAID’s, COX-2-remmers, thiazolidinedionen of corticosteroïden kunnen acuut hartfalen uitlokken, met name bij mensen die bekend zijn met chronisch hartfalen. De prognostische indicatoren bij acuut hartfalen zijn dezelfde als bij chronisch hartfalen.Noot 47
Diagnostiek bij acuut hartfalen
De huisarts stelt de diagnose acuut hartfalen primair op anamnese en lichamelijk onderzoek.
Lichamelijk onderzoek
- Algemene indruk en beoordeling van de perifere circulatie en huidtemperatuur. Veelal is de patiënt (half) zittend gepositioneerd, met een angstige blik in de ogen, heeft een reutelende/tachypnoïsche ademhaling, ziet bleek/grauw en de huid voelt koud/klam.
- Pols. Meestal is deze tachycard en ‘dun’ door (nor)adrenaline.
- Bloeddruk. Deze kan hoog (door (nor)adrenaline), normaal of laag zijn. Bij lage bloeddruk is het hart te zwak om ondanks hoge spiegels (nor)adrenaline de bloeddruk te handhaven. Een lage bloeddruk is het meest bedreigend.
- Auscultatie van het hart. Geruisen en een derde of vierde harttoon. Mitralisklepinsufficiëntie komt frequent voor bij acuut hartfalen. Bij een heftig reutelende patiënt is auscultatie van het hart (nagenoeg) onmogelijk.
- Auscultatie van de longen. Tweezijdig basaal crepiteren, maar ook rhonchi en pulmonaal piepen door bronchoconstrictie (‘asthma cardiale’) zijn symptomatisch voor een verhoogde vullingsdruk in het linker atrium, die zich voortzet in het veneuze longvaatbed. Vooral bij een acute exacerbatie van chronisch hartfalen kan ook demping en nauwelijks of geen ademgeruis basaal (passend bij pleuravocht) aantoonbaar zijn. Het ontstaan van pleuravocht neemt veelal uren tot dagen in beslag.
- Centraalveneuze druk. Deze is verhoogd, passend bij een verhoogde vullingsdruk in het rechter atrium. Bij erg dyspnoïsche patiënten wordt de patiënt niet neergelegd om dit te vast te stellen, omdat dit te belastend is.
Behandeling
Als (aan de telefoon) blijkt dat er sprake is van een ernstig benauwde, reutelende patiënt of een benauwde patiënt met aanhoudende pijn op de borst, is een spoedvisite geïndiceerd. Geef alvast het advies de patiënt rechtop te laten zitten. Overweeg de patiënt, als deze nitroglycerine of isosorbidedinitraat onder de tong gebruikt voor angineuze klachten, een tabletje of pufje te laten nemen ongeacht of er pijn op de borst is. Hierbij neemt de huisarts een ‘gewogen’ risico: het risico op bloeddrukdaling door nitraatgebruik tegen het voordeel van zo snel mogelijk starten met deze behandeling. Primair gaat het om symptoomverbetering en hemodynamische stabilisering. Diuretica en vaatverwijders (nitraten) worden gegeven ter vermindering van dyspneu als gevolg van longstuwing. De volgende behandelingen worden bij acuut hartfalen geadviseerd:
Lisdiuretica
Een lisdiureticum wordt aanbevolen bij acuut hartfalen bij symptomen als gevolg van veneuze stuwing of vochtretentie.Noot 48 Bij matige vochtretentie wordt oraal of intraveneus furosemide 20-40 mg of bumetanide 0,5-1 mg gegeven. Bij ernstige vochtretentie kan, afhankelijk van de ernst en titrerend op geleide van de respons, furosemide i.v. worden opgehoogd tot 100 mg of bumetanide tot 4 mg oraal of i.v. Patiënten met hypotensie (systolische bloeddruk < 90 mmHg), ernstige hyponatriëmie of acidose reageren minder goed op diuretische behandeling. Hoge doses diuretica kunnen leiden tot hypovolemie en hyponatriëmie.
Vaatverwijders
Nitraten worden aanbevolen als vaatverwijders bij acuut hartfalen als er geen sprake is van symptomatische hypotensie, een systolische bloeddruk < 90 mmHg of ernstige obstructieve hartklepaandoeningen.Noot 49 Deze middelen verlagen de bloeddruk, verlagen de linker en rechter vullingsdrukken en de systemische perifere weerstand, en doen daarmee de dyspneu afnemen. In de thuissituatie kan sublinguale toediening snel effectief zijn. Tot de klachten voldoende verbeteren of de bloeddruk daalt < 90 mmHg kan elke drie minuten 0,8-1,6 mg nitroglycerine oromucosaal worden toegediend.
Zuurstof
Toediening van zuurstof wordt aanbevolen bij hypoxemische patiënten (5-20 l/min. is gebruikelijk). Gestreefd wordt naar een zuurstofsaturatie > 95% (bij COPD-patiënten > 90%). Bij patiënten met ernstig COPD is waakzaamheid geboden voor hypercapnie en kan 2 l/min. gegeven worden.
Morfine en morfine-analogen bij acuut hartfalen
Morfine kan worden toegepast in de vroege fase van acuut hartfalen, in het bijzonder bij onrust, dyspneu, angst of pijn op de borst.Noot 50 Toediening van een intraveneuze bolus van 2,5-5 mg kan worden herhaald zo vaak als nodig is. Voorzichtigheid is geboden bij patiënten met hypotensie, bradycardie, tweede- of derdegraads AV-blok of CO2-retentie.
Verwijzing
De patiënt wordt verwezen bij onvoldoende resultaat van de behandeling, ontoereikende zorgmogelijkheden of een vermoeden van een myocardinfarct als oorzaak of andere (invasief) behandelbare oorzaak voor het acute hartfalen.
Vervolgbehandeling na acute episode
Zo spoedig mogelijk na stabilisatie van acuut hartfalen dient in principe behandeling voor chronisch hartfalen te worden ingesteld of bijgesteld. Patiënten met acuut hartfalen als eerste uitingsvorm van hartfalen hebben een grote kans om chronisch hartfalen te ontwikkelen. Aan deze patiënten worden daarom ACE-remmers of AII-antagonisten gegeven. Bij patiënten met acuut gedecompenseerd chronisch hartfalen wordt aanbevolen om tijdelijk de dosis bètablokkers te verlagen of geheel te stoppen bij complicaties zoals bradycardie, tweede- of derdegraads AV-blok, persisterend bronchospasme of cardiogene shock, of in gevallen van ernstig acuut hartfalen met een slechte respons op therapie. Gezien de kans op reflextachycardie en -hypertensie en het voor de lange termijn gunstige werkingsprofiel van bètablokkers, worden zij gecontinueerd in de vervolgfase na de acute episode.
Palliatieve en terminale zorg bij hartfalen
Ernstig hartfalen kent een zeer slechte éénjaarsoverleving.Noot 51 Hartfalen heeft een moeilijk voorspelbaar ziektebeloop met acute exacerbaties en het is vaak moeilijk om het moment te bepalen waarop therapeutische zorg zou moeten overgaan in palliatieve zorg. In de praktijk worden hartfalers regelmatig opgenomen en gaat hun klinische conditie steeds verder achteruit. Zij worden gewoonlijk niet verwezen naar gespecialiseerde palliatieve zorgcentra. In de eindfase draait alles om het ‘maximaliseren’ van het comfort van de patiënt en is het beleid niet meer gericht op verlenging van de levensduur. Een aantal aspecten van de terminale zorg bij hartfalen is gelijk aan die bij andere aandoeningen (zoals kanker). Voor angst, onrust en pijn worden ook anxiolytica, haldol en morfine gebruikt. Een belangrijk verschil tussen de terminale zorg bij hartfalen en de terminale zorg bij een maligniteit is dat de hartfalenmedicatie grotendeels wordt gecontinueerd omdat het ook de belangrijkste klachtenverlichtende medicatie is bij deze patiënten. Ernstige kortademigheid in de eindfase kan worden bestreden met morfine. In Nederland worden patiënten met eindstadium hartfalen veelal thuis behandeld. Wanneer een gespecialiseerd palliatiezorgteam bij de behandeling betrokken is, dienen er goede afspraken gemaakt te worden en en goede communicatie te zijn tussen het hartfalenteam, de huisarts en het palliatief team.
Multidisciplinaire ‘ketenzorg’ en hartfalenzorgprogramma’s
De multidisciplinaire zorgketen rondom een patiënt dient door optimale samenwerking zo goed mogelijk afgestemde zorg te bieden. Samenhangende zorgverlening vereist dat de zorgverleners niet alleen weten wat zij zelf moeten doen, maar ook weten wat de patiënt en de andere zorgverleners doen. De benoeming van een zorgcoördinator is hierbij een punt van aandacht. Hartfalenzorgprogramma’s beogen optimale coördinatie van multidisciplinaire zorg.Noot 52 De zorg is vooral complex bij patiënten met recidiverende ziekenhuisopnames. Zowel het ziekenhuisteam als het thuisteam zijn dan continu en in wisselende mate betrokken bij de zorg voor de patiënt. Optimale samenwerking volgens een gestructureerd zorgprogramma is een voorwaarde voor kwalitatief hoogwaardige zorg. Hierbij hoort een zorgvuldige overdracht bij ontslag. Ook moeten wijzigingen in het beleid, en de redenen daarvoor, naar alle betrokken hulpverleners gecommuniceerd worden. Multidisciplinaire hartfalenteams kunnen bestaan uit verpleegkundigen, cardiologen, huisartsen, praktijkondersteuners, fysiotherapeuten, diëtisten, psychologen, geriaters, verpleeghuisartsen, apothekers en anderen. Op regionaal niveau moeten goede afspraken worden gemaakt om de zorg voor hartfalenpatiënten te optimaliseren. De wensen en verwachtingen van de patiënt vormen hierbij mede een leidraad. Naast het medisch-inhoudelijke aspect van het zorgprogramma moet ook aandacht worden geschonken aan de (lokale) samenwerking tussen zorgverleners en aan de implementatie van de afspraken.
Totstandkoming
De NHG-Standaard Hartfalen is afgeleid van de Multidisciplinaire richtlijn Hartfalen 2010, die is opgesteld door vertegenwoordigers van alle relevante specialismen die te maken hebben met hartfalen. In januari 2007 startte de werkgroep met het schrijven van de Multidisciplinaire richtlijn Hartfalen 2010. Het project werd gesubsidieerd vanuit het programma Kennisbeleid Kwaliteit Curatieve Zorg van ZonMw. Vanuit de betrokken Nederlandse wetenschappelijke beroepsverenigingen werd afvaardiging gevraagd en verkregen (zie Samenstelling van de werkgroep met affiliaties). De basis van de Multidisciplinaire richtlijn Hartfalen 2010 wordt gevormd door de Europese richtlijn van de European Society of Cardiology: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM): Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJV, Ponikowski P, Poole-Wilson PA, Strömberg A, Veldhuisen DJ van, Atar D, Hoes AW, Keren A, Mebazaa A, Nieminen M, Priori SG and Swedberg K. http://.escardio.wwworg/guidelines-surveys/esc-guidelines/Pages/acute-chronic-heart-failure.aspx. Ook werd gebruik gemaakt van de CBO multidisciplinaire Richtlijn Chronisch Hartfalen 2002 en van de NHG-Standaard Hartfalen 2005.
In juli 2009 startte een werkgroep met de tweede herziening van de NHG-Standaard Hartfalen. De werkgroep bestond uit de volgende leden: prof.dr. A.W. Hoes, klinisch epidemioloog; dr. A.A. Voors, cardioloog; dr. F.H. Rutten, huisarts; J. van Lieshout, huisarts; dr. E.P. Walma, huisarts. Zij maakten eveneens deel uit van de multidisciplinaire werkgroep Hartfalen. De begeleiding van de NHG-werkgroep berustte bij dr. P.G.H. Janssen, huisarts, wetenschappelijk medewerker van de afdeling Richtlijnontwikkeling en Wetenschap van het NHG. Dr. T. Wiersma, huisarts was bij de totstandkoming betrokken als senior-wetenschappelijk medewerker van deze afdeling. De NHG-Standaard is op 12 mei 2010 geautoriseerd door de Autorisatiecommissie van het NHG. © 2010 Nederlands Huisartsen Genootschap
Samenstelling multidisciplinaire werkgroep met affiliaties
Prof.dr. A.W. Hoes, voorzitter, klinisch epidemioloog, namens de Vereniging voor Epidemiologie, Julius Centrum voor Gezondheidswetenschappen en Eerstelijnsgeneeskunde, UMC Utrecht. Dr. A.A. Voors, vice-voorzitter, cardioloog, namens de NVVC, afdeling Cardiologie/Thoraxcentrum, UMC Groningen. Dr. E.P. Walma, projectleider, huisarts, NHG. H.J.H. in den Bosch, adviseur, Landelijk Expertisecentrum Verpleging &Verzorging. Prof. dr. M.L. Bouvy, apotheker, namens de KNMP, Departement Farmaceutische Wetenschappen, afdeling Farmacoepidemiologie en Farmacotherapie, UMC Utrecht. Prof. dr. E. Buskens, MTA-deskundige, afdeling Epidemiologie, UMC Groningen. G.M. Duin, diëtist, Nederlandse Vereniging van Diëtisten. Dr. P. van Dijk, sociaal geneeskundige, namens Zorgverzekeraars Nederland. J.L. van Dijk, bedrijfsarts, namens NVAB, polikliniek Mens en Arbeid, Nederlands Centrum voor Beroepsziekten, AMC Amsterdam. R. Dijkgraaf, cardioloog, namens de NVVC, afdeling Cardiologie, Ziekenhuis St. Jansdal, Harderwijk. J. van Erp, psycholoog, namens de Nederlandse Hartstichting. Dr. L. van Erven, cardioloog, namens de NVVC, afdeling Cardiologie, LUMC. Dr. T.L. Feenstra, MTA-deskundige, afdeling Epidemiologie, UMC Groningen. E. Fischer, psycholoog, richtlijnadviseur, Trimbos-instituut. S. Flikweert, huisarts, NHG. M. de Graaff, Stichting Hoofd Hart en Vaten, in 2009 opgegaan in De Hart&Vaatgroep. R. Hammelburg, onderwijskundige/projectadviseur, NHG. Prof. dr. A. Honig, psychiater, namens de NVP, Sint Lucas Andreas Ziekenhuis/VUmc. Dr. H.J. Hulzebos, fysiotherapeut, namens het KNGF. Dr. T. Jaarsma, verpleegkundige, afdeling Cardiologie, UMC Groningen. Dr. R.W.M.M. Jansen, klinisch geriater, namens de Nederlandse Vereniging voor Klinische Geriatrie J.J.J. Janssen-Boyne, MA ANP, verpleegkundige, namens de NVHVV, UMC Maastricht. H. Koers, fysiotherapeut, namens het KNGF. I.H.M. de Kok, diëtist, namens de NVD. M. Kortrijk, verpleegkundige, namens V&VN-Eerstelijnsverpleegkundigen. M.W.F. van Leen, specialist ouderengeneeskunde, namens Verenso, Advies- en BehandelCentrum Avoord Zorg & Wonen. J. van Lieshout, huisarts, namens het NHG, afdeling IQ healthcare, UMC St. Radboud. P.A. Ninaber, verpleegkundige, namens de NVHVV. E. Poot, verpleegkundige en senior adviseur, namens het LEVV. Dr. P.N. Post, epidemioloog, Kwaliteitsinstituut voor de Gezondheidszorg CBO. R. Rohling, specialist ouderengeneeskunde, namens Verenso, Ter Valcke, vakgroep BOA. C.J.G.M. Rosenbrand, arts, Kwaliteitsinstituut voor de Gezondheidszorg CBO. Dr. F.H. Rutten, huisarts, namens het NHG, Julius Centrum voor Gezondheidswetenschappen en Eerstelijnsgeneeskunde, UMC Utrecht. Dr. A.A.J.J. Schiffer, gezondheidspsycholoog, namens het NIP, TweeSteden ziekenhuis polikliniek, Tilburg. Dr. Th. B Twickler, internist-endocrinoloog, namens de NIV, afdeling Vasculaire Geneeskunde, AMC/UvA, Amsterdam. Prof. dr. D.J. van Veldhuisen, cardioloog namens de NVVC, afdeling Cardiologie/Thoraxcentrum, UMC Groningen. M. Weerts, directeur van Stichting Hoofd Hart en Vaten, in 2009 opgegaan in De Hart&Vaatgroep.
Voetnoten
- Noot 1.↲
Multidisciplinaire richtlijn en internationalisering De NHG-Standaard hartfalen is gebaseerd op de Multidisciplinaire richtlijn Hartfalen 2010. Deze op zijn beurt is gebaseerd op de Europese richtlijn: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology [Dickstein 2008]. Er zijn meerdere argumenten die pleiten voor internationalisering. De cardiologen in Nederland aanvaarden als beroepsgroep al jarenlang de ESC-richtlijn, daarom zijn diverse onderdelen uit de ESC-richtlijn letterlijk vertaald opgenomen in de Nederlandse multidisciplinaire richtlijn. Waar het onderwerpen betrof die specifiek te maken hadden met de Nederlandse situatie, is de tekst gewijzigd of zijn er delen toegevoegd [Rutten 2005a]. Deze NHG-Standaard Hartfalen beschrijft de aanbevelingen uit de multidisciplinaire richtlijn voorzover deze relevant zijn voor de huisarts.
- Noot 2.↲
Prevalentie Schattingen over de prevalentie van hartfalen in Nederland zijn gebaseerd op prevalentiegegevens uit huisartsenregistraties en betreffen hoofdzakelijk klinisch gestelde diagnoses (zonder echocardiografische bevestiging [Hoes 2009; Van der Lucht 2010]. In bevolkingsonderzoeken in de jaren negentig werden overeenkomstige cijfers gevonden, waarbij de diagnose gebaseerd was op klachten, verschijnselen en echocardiografische afwijkingen [Bleumink 2004; Mosterd 2007]. De prevalentie neemt toe met de leeftijd [Poos 2006]. Gegevens over sterfte komen van het CBS en uit het buitenland [Bhatia 2006; Owan 2006; Statistics Netherlands (CBS) 2010].
- Noot 3.↲
Klinische manifestaties van hartfalen [[tbl:2956]]
- Noot 4.↲
Ernst van hartfalen Mild, matig en ernstig hartfalen zijn termen die gebruikt worden om de ernst van de klinische symptomen te beschrijven. De meest gebruikte classificatie om de ernst van de klinische symptomen te beschrijven is die van de New York Heart Association (NYHA). De NYHA-classificatie is in de klinische praktijk nuttig en heeft prognostische waarde [American Heart Association 1994; Hunt 2005; NYHA 1999]. Patiënten die ooit symptomatisch zijn geweest en door behandeling asymptomatisch zijn geworden, worden ingedeeld in NYHA-klasse I.
- Noot 5.↲
Onderliggende oorzaken van hartfalen De meest voorkomende oorzaken zijn coronaire hartziekte en hypertensie. (Zie tabel 4.) [[tbl:2959]]
In specifieke subpopulaties, secundair aan metabole belasting of een coëxistente aandoening, worden reversibele cardiomoypathieën waargenomen [Elliott 2008]. De eerste manifestatie is vaak al op jonge leeftijd (< 40 jaar). Een aantal van deze merendeels endocriene aandoeningen wordt door onbekendheid bij artsen vaak laat herkend. In dit verband kunnen onder andere worden genoemd: peripartumcardiomyopathie, ijzergeïnduceerde cardiomyopathie, acromegaliegeassocieerde cardiomyopathie, schildklier- of gravescardiomyopathie, cushinggerelateerde cardiomyopathie en amyloïdcardiomyopathie.
- Noot 6.↲
Factoren die het sterkst gerelateerd zijn aan een slechte prognose bij patiënten Tabel 5, gebaseerd op de ESC-richtlijn, toont allerlei factoren die elk voor zich een ongunstig effect op de prognose hebben [Dickstein 2008]. (Zie tabel 6.)
[[tbl:2961]]
- Noot 7.↲
Streefwaarden bij hoge bloeddruk Optimale streefwaarden zijn niet bekend, maar de huidige CBO-richtlijn Cardiovasculair risicomanagement 2006 en de ESC-richtlijn ter preventie van cardiovasculaire aandoeningen uit 2007 noemen 140/90 mmHg als algemene streefwaarde bij hoge bloeddruk. Lagere streefwaarden worden geadviseerd bij diabetes- en andere hoogrisicopatiënten, waaronder patiënten met eindorgaanschade (hartfalen, CVA, myocardinfarct, nierinsufficiëntie of proteïnurie) [CBO Kwaliteitsinstituut voor de Gezondheidszorg 2006; Graham 2007].
- Noot 8.↲
Nierfunctiestoornissen Er is bij hartfalen een sterk verband tussen nierinsufficiëntie en morbiditeit en mortaliteit [Smith 2006]. Met hartfalen samenhangende oorzaken van een verslechterde nierfunctie zijn hypotensie, dehydratie en medicatie (diuretica, ACE-remmers, AII-antagonisten) [Hunt 2005]. Verwijzing naar de tweede lijn is aangewezen bij patiënten met macroalbuminurie ongeacht de hoogte van de berekende creatinineklaring, patiënten < 65 jaar met een creatinineklaring < 45 ml/min., patiënten > 65 jaar met een creatinineklaring < 30 ml/min. en patiënten met een vermoeden van een onderliggende nierziekte [De Grauw 2009].
- Noot 9.↲
COPD COPD en hartfalen komen vaak voor bij een en dezelfde persoon. Over de problemen die de combinatie van hartfalen en COPD met zich meebrengt voor diagnostiek, prognose en therapie is veel onderzoek beschikbaar [Le Jemtel 2007; Macchia 2007; Shelton 2006; Rutten 2005b; Rutten 2006; Sin 2005; Egred 2005; Salpeter 2002]. Bij mensen bekend met stabiel COPD in de huisartsenpraktijk bleek ook het afkappunt voor geleidelijk nieuw hartfalen bruikbaar te zijn om hartfalen uit te sluiten (zie ook noot 16) [Rutten 2005c]. Inhalatietherapie met bèta-agonisten is bij hartfalen niet gecontra-indiceerd, maar wegens een verhoogde kans op ritmestoornissen dient niet onnodig hoog te worden gedoseerd [Singh 2008; Au 2003; Au 2004; Bouvy 2000]. Inhalatie van parasympathicolytica en corticosteroïden lijkt geen grote problemen te geven. Orale corticosteroïden kunnen hartfalen doen verergeren door vochtretentie [Rutten 2006].
- Noot 10.↲
Anemie Bij hartfalen worden prevalenties van anemie gemeld van 4-70% [Felker 2004; Tang 2006]. Het betreft meestal anemie van chronische ziekte en de anemie gaat vaak gepaard met verminderd inspanningsvermogen, toegenomen vermoeidheidsgevoel en een slechtere kwaliteit van leven [Felker 2004; Tang 2006]. Anemie is bij hartfalen een onafhankelijke risicofactor voor ziekenhuisopname en mortaliteit. De belangrijkste oorzaken van anemie bij hartfalen zijn hemodilutie, nierinsufficiëntie, ondervoeding, chronische ontsteking, beenmergdepressie, ijzertekort en bijwerkingen van medicatie [Nanas 2006; Tang 2006; Opasich 2005; Felker 2004; Gosker 2003]. Het nut van erytropoëtine wordt op dit moment onderzocht [Okonko 2008; Ponikowski 2007; Van Veldhuisen 2007; Mancini 2003].
- Noot 11.↲
Depressie en angst De prevalentie van depressie en angststoornissen bij hartfalen is beperkt onderzocht, maar beide komen veel voor, met een prevalentie van 20-30% [Freedland 2003; Haworth 2005]. Zij verhogen ook het sterfterisico [Koenig 2007]. De ernst van het hartfalen is een belangrijke voorspeller voor het optreden van cerebrovasculaire schade en wittestofafwijkingen, en herseninfarcten bleken bij MRI-onderzoek geassocieerd met depressie en angststoornissen [Vogels 2007c]. Het schaarse beschikbare onderzoek levert geen evidentie dat psychotherapie effect heeft op depressies bij patiënten met hartfalen [Lane 2005]. Er is enige evidentie dat SSRI’s (paroxetine en sertraline) wel effect hebben op depressies bij deze patiënten [Gottlieb 2007; Parissis 2007], maar voorzichtigheid is geboden. Geneesmiddeleninteracties tussen SSRI’s en hartfalenmedicatie komen veel voor en kunnen leiden tot ernstige complicaties zoals hyponatriëmie en bloedingen [Schalekamp 2008; Opatrny 2008; Jacob 2006]. Voorwaarde om toch tot behandeling over te gaan is dat er sprake is van een klinisch relevante depressie.
- Noot 12.↲
Cognitieve disfunctie en dementie Cognitieve stoornissen en dementie zijn bij ouderen met hartfalen niet zeldzaam [Van der Wel 2007]. Cognitieve stoornissen komen bij patiënten met hartfalen meer voor dan bij gezonde personen. Vogels et al. vonden in een systematische review naar de relatie van hartfalen en cognitieve stoornissen dat patiënten met hartfalen een risico hadden van 62% op gelijktijdig aanwezige cognitieve stoornissen [Vogels 2007a]. In enkele onderzoeken naar het specifieke profiel van de cognitieve stoornissen bij patiënten met hartfalen werden stoornissen in het geheugen, de aandacht en de mentale snelheid gevonden [Bennett 2003; Almeida 2001]. Vogels vond in een recent onderzoek naar het neuropsychologische profiel van de cognitieve stoornissen bij patiënten met hartfalen globale stoornissen in verschillende cognitieve domeinen, zoals geheugen, aandacht en uitvoerende functies [Vogels 2007b]. Bij deze patiënten kwamen depressieve stoornissen eveneens veel voor. Stoornissen in de uitvoerende functies zijn een belangrijk onderdeel van de cognitieve stoornissen bij patiënten met hartfalen [Vogels 2007b]. Ze zijn vaak lastig te onderkennen. Deze patiënten weten bijvoorbeeld wel welke medicatie zij moeten innemen en wat zij zouden moeten doen, maar missen de intrinsieke prikkel om tot daadwerkelijke activiteit te komen. Een MMSE is ongeschikt om stoornissen in deze executieve functies op te sporen. De ernst van hartfalen is een belangrijke voorspeller voor het optreden van cerebrovasculaire schade en atrofie van de mediaal-temporale kwab, en is onafhankelijk geassocieerd met geheugenstoornissen en executieve functiestoornissen [Vogels 2007c, Vogels 2007d].
- Noot 13.↲
Anamnese Bij de anamnese moeten de klachten kortademigheid en vermoeidheid of perifeer oedeem aan de diagnose hartfalen doen denken. Deze klachten kunnen echter ook het gevolg zijn van vele andere aandoeningen [Remes 1991]. Minder frequent voorkomende klachten, zoals orthopneu en paroxismale nachtelijke dyspneu, hebben wel een beperkte positief voorspellende waarde [Davie 1997]. Een doorgemaakt myocardinfarct is het belangrijkste gegeven uit de voorgeschiedenis dat de diagnose hartfalen waarschijnlijker maakt [Davie 1997].
- Noot 14.↲
Lichamelijk onderzoek Bij een verdenking op hartfalen dient een gericht en zorgvuldig lichamelijk onderzoek te worden verricht, inclusief observatie, palpatie en auscultatie. Bij het lichamelijk onderzoek gaat men na of er sprake is van een verhoogde centraalveneuze druk, hartgeruisen, een naar lateraal verplaatste ictus cordis (zowel in rug- als in zijligging), een S3-galop en/of perifeer oedeem. Een lichte vorm van onderbeenoedeem komt veel voor, dit is veelal het gevolg van veneuze insufficiëntie en het is niet specifiek voor hartfalen. Een bij palpatie in linker zijligging (75-90°) heffende of verbrede ictus (> 2 vingers palpabel) kan wijzen op hartfalen, en kan ook gevonden worden bij patiënten met hartfalen zonder overvulling [Rutten 2005b; Rutten 2006]. Pulmonale crepitaties, verhoogde centraalveneuze druk (CVD), perifeer oedeem en een galopritme (bij zeer forse druk- en/of volumeoverbelasting van de linker ventrikel) komen voor bij overvulling en dragen vooral bij aan het stellen van de diagnose hartfalen [Badgett 1997, Davie 1997]. De CVD wordt gemeten volgens de methode van Lewis-Borst-Molhuijsen. Laat de patiënt in liggende of half zittende houding het hoofd in lichte retroflexie houden. Bepaal het laagste punt waarop de oppervlakkige halsvene tijdens inspiratie collabeert terwijl deze bij de kaakhoek wordt dichtgedrukt. Zorg voor tangentiële belichting. De waarde van deze methode is onderzocht bij 400 patiënten. Bij ruim 90% was de CVD op deze wijze nauwkeurig en betrouwbaar te bepalen. Met de methode van Lewis-Borst-Molhuijsen lag het laagste punt waar de oppervlakkige halsvenen collabeerden bij ruim 90% van 332 personen zonder hart- of longziekten 4 cm of meer lager dan het referentiepunt (de aanhechtingsplaats van de tweede rib aan het sternum). Een normale CVD is derhalve kleiner dan R – 4 [Borst 1952].
- Noot 15.
Elektrocardiogram (ecg) Een normaal ecg maakt de diagnose hartfalen erg onwaarschijnlijk (< 2% bij vermoeden van acuut hartfalen en < 10-14% bij vermoeden van geleidelijk ontstaan hartfalen) [Badgett 1997; Davie 1996; Khunti 2004; Nielsen 2000; Zaphiriou 2005]. Een abnormaal ecg heeft een geringe positief voorspellende waarde voor de diagnose hartfalen. Het meest voorspellend zijn een pathologische Q-golf en een linkerbundeltakblok (cLBTB) [Badgett 1997]. Er is geen kenmerkende ecg-afwijking die bij hartfalen past.
- Noot 16.↲
De B-type natriuretische peptiden (BNP en NT-proBNP) Naast een mechanische functie heeft het hart ook een endocriene functie. Myocyten produceren in reactie op rek natriuretische peptiden. Deze vasoactieve hormonen worden extra aangemaakt bij toegenomen wandspanning ten gevolge van druk- en volumeoverbelasting [Maisel 2002; Mueller 2004]. De atria produceren voornamelijk atriaal natriuretisch peptide (ANP), de ventrikels produceren B-type natriuretisch peptide (BNP) en het aminoterminale afsplitsingsproduct van het prohormoon daarvan, NT-proBNP. De plasmaconcentratie van B-type natriuretische peptides is een maat voor hartfalen. Zowel voor toepassing bij de diagnostiek, ernstgradering als prognostiek is er wetenschappelijke onderbouwing maar ze hebben vooral een belangrijke functie bij het uitsluiten van hartfalen bij mensen met klachten of verschijnselen van hartfalen [Jourdain 2007, Chen 2006, Troughton 2000]. Er is vooralsnog echter weinig onderbouwing voor een medicamenteuze behandeling op geleide van het (NT-pro)BNP-gehalte. Een hoog (NT-pro)BNP ondanks adequate behandeling is prognostisch ongunstig. Bij acuut nieuw hartfalen wordt de wandspanning abrupt verhoogd en zijn de (NT-pro)BNP-waarden hoger dan bij geleidelijk nieuw hartfalen. Acuut nieuw hartfalen geeft dus veel hogere bloedspiegels dan geleidelijk ontstaan hartfalen. Dit is de reden dat verschillende afkapwaarden worden gehanteerd.
- Bij verdenking op ‘geleidelijk’ nieuw hartfalen wordt, op basis van een systematische review uit 2004 aangevuld met later onderzoek, ‘ter uitsluiting’ van hartfalen als afkappunt voor NT-proBNP 125 pg/ml (? 15 pmol/l) gehanteerd [Doust 2004; Fuat 2006; Gustafsson 2005; Nielsen 2004; Zaphiriou 2005]. Bij dit afkappunt is de negatief voorspellende waarde 92-99% en de positief voorspellende waarde 15-57%, bij een priorkans op hartfalen van 9-38%.
- Bij verdenking op ‘acuut’ nieuw hartfalen is in onderzoek als optimaal ‘uitsluitafkappunt’ voor NTproBNP 300 pg/ml berekend (positief voorspellende waarde 77%, negatief voorspellende waarde 98%) bij een prevalentie van acuut hartfalen van 57% . In deze richtlijn is gekozen voor het iets hogere adviesafkappunt van 400 pg/ml conform het advies in de ESC-richtlijn .
- Bij verdenking op ‘geleidelijk’ nieuw hartfalen is een afkapwaarde voor BNP van 30-78 pg/ml berekend, met een negatief voorspellende waarde van 85-98% en een bij een priorkans van 27-38% [Cowie 1997; Fuat 2006; Krishnaswamy 2001; Yamamoto 2000; Zaphiriou 2005]. Als diagnostische afkapwaarde is in deze richtlijn gekozen voor 35 pg/ml.
- Bij verdenking op ‘acuut’ nieuw hartfalen bleek in onderzoek het optimale ‘uitsluitafkappunt’ voor BNP 50 pg/ml te zijn (positief voorspellende waarde 71%, negatief voorspellende waarde 96%) voor de diagnose hartfalen . Bij 100 pg/ml is de positief voorspellende waarde 79% en negatief voorspellende waarde 89%. Dit bij een prevalentie van acuut nieuw hartfalen van 47%. In deze richtlijn is gekozen voor het afkappunt 100 pg/ml.
Behalve hartfalen kunnen ook andere cardiale en niet-cardiale condities leiden tot verhoogde bloedspiegels van (NT-pro)BNP. Bij acute klachten kan het gaan om acuut coronair syndroom, pulmonale hypertensie bijvoorbeeld door multipele longembolieën of ernstig COPD, tachycardie en ernstige nierfunctiestoornissen. Bij minder acuut begonnen klachten kunnen ook atriumfibrilleren (of andere ritmestoornissen), hoge leeftijd, ernstige infectie en nierfunctiestoornissen de oorzaak van de verhoogde spiegels zijn. Obesitas leidt tot lagere bloedspiegels (NT-pro)BNP [Van Kimmenade 2006]. Regionale laboratoria gebruiken vaak andere afkappunten dan hierboven aangegeven. Dit komt omdat zij hun referentiewaarden veelal baseren op de laboratoriumaanvragen die zij krijgen. Dit zijn zowel aanvragen van de specialist (veelal de cardioloog) als van de huisarts. Dit leidt ertoe dat de afkappunten van die regionale laboratoria meestal tussen de aangegeven afkapwaarden van geleidelijk nieuw en acuut nieuw hartfalen in liggen. De werkgroep adviseert nadrukkelijk de hierboven aangegeven afkappunten te gebruiken. De werkgroep heeft gekozen voor niet-leeftijdsspecifieke en niet-geslachtsspecifieke afkappunten, omdat dit voor het uitsluiten van hartfalen nauwelijks effect heeft. Bovendien zou het het diagnostische schema te complex maken.
- Noot 17.↲
Laboratoriumonderzoek Aanvullend laboratoriumonderzoek kan toegevoegde waarde hebben voor het opsporen van mogelijke oorzaken van hartfalen of voor het vaststellen van eventuele comorbiditeit. Laboratoriumonderzoek (natrium, kalium, creatinine en berekende klaring) kan ook van belang zijn om uitgangswaarden voor behandeling te verkrijgen indien de patiënt hartfalen blijkt te hebben. (Zie tabel 6.) [[tbl:2963]]
Cardiale troponines komen vrij bij necrose van cardiomyocyten en verhoogde concentraties in het bloed wijst op een acuut coronair syndroom of langdurige myocardischemie. Bij hartfalen hebben verhoogde troponinewaarden in combinatie met verhoogde natriuretische peptides een sterk negatieve prognostische betekenis.
- Noot 18.↲
Echocardiografie (Doppler)echocardiografie is niet-invasief, veilig en snel uitvoerbaar. Het levert informatie op over de anatomie van het hart (volumes, vorm en wanddiktes), wandbewegingen, algehele pompfunctie en klepfunctie. Elke patiënt bij wie na anamnese, lichamelijk onderzoek en aanvullend onderzoek twijfel blijft bestaan over de diagnose hartfalen moet echocardiografisch worden onderzocht. Echocardiografie is ook geschikt voor het vaststellen van een aantal oorzaken van hartfalen zoals klepgebreken. De meest gebruikte maat voor de linkerventrikelfunctie is de linkerventrikelejectiefractie (LVEF), die normaal ? 55% is. Hiermee onderscheidt men systolisch (LVEF < 45%) en diastolisch (LVEF ? 45%) hartfalen. Een beperking is dat de LVEF afhankelijk is van de vulling en de vorm van het hart. Een gedilateerd hart met een toegenomen LV-einddiastolisch volume kan bij goede vulling met geringe pompkracht toch voldoende cardiac output geven, ondanks een lage LVEF. Sommige mensen met een LVEF van 30% of lager zijn daardoor toch nog tot relatief grote lichamelijke inspanning in staat. Anderzijds zal een hypertrofisch hart met een klein einddiastolisch volume bijna altijd een normale LVEF hebben, maar kan het hart toch ernstig tekortschieten wat betreft de cardiac output. De wanden van zo’n hypertrofisch hart zijn namelijk niet alleen verdikt, maar ook fibrotisch veranderd en daardoor stugger geworden. Zij kunnen minder goed relaxeren met als gevolg beperkte vulmogelijkheid tijdens de diastole. Zo’n hypertrofische linker ventrikel kan slechts een fractie uitpompen van hetgeen in de ventrikel aanwezig is. Bij deze patiënten spreekt men van diastolische disfunctie. Een diastolische linkerventrikeldisfunctie kan op verschillende manieren worden vastgesteld. Traditioneel legt men met een dopplertechniek de diastolische bloedstroom door de mitralisklep vast, en kijkt men naar de flow in de v. pulmonalis en naar diameter en volume van het linker atriun. Momenteel wordt ‘tissue doppler imaging’ (TDI) gezien als de meest betrouwbare methode om een diastolische disfunctie vast te stellen [Paulus 2007]. In het geval van atriumfibrilleren worden de mogelijkheden tot bepaling en interpretatie van de LVEF en diastolische functie ernstig beperkt doordat de parameters per hartslag wisselen. In speciale gevallen waarbij het venster van de transthoracale echo niet volstaat kan een transoesofageale echo worden gemaakt (bijvoorbeeld bij obesitas of wanneer men behoefte heeft aan gedetailleerde beoordeling van de kleppen vanwege een verdenking op endocarditis).
- Noot 19.↲
Thoraxfoto In een systematische review concludeerden Badgett et al. dat pulmonale redistributie (relatief groot kaliber van de vaten in de bovenvelden ten opzichte van de ondervelden) en cardiomegalie (cardiothoracale ratio > 0,50) de beste röntgenologische parameters zijn voor de diagnostiek van hartfalen [Badgett 1996]. Nielsen et al. vonden echter geen verband tussen het voorkomen van afwijkingen op de thoraxfoto en een systolische disfunctie (LVEF < 40%) [Nielsen 2000]. Op de thoraxfoto kan overvulling soms duidelijk zijn. Anderzijds kan bij patiënten met vergevorderde stadia van hartfalen soms geen enkele afwijking op de thoraxfoto worden gevonden. Een thoraxfoto met afwijkingen kan dus bijdragen aan het stellen van de diagnose hartfalen, maar een thoraxfoto zonder afwijkingen sluit hartfalen niet uit. Een X-thorax heeft beperkte waarde bij een vermoeden van nieuw ontstaan hartfalen. Röntgenonderzoek is wel belangrijk om hartfalen te differentiëren van eventuele pulmonale oorzaken.
- Noot 20.↲
Aanvullend onderzoek
- Cardiale ischemie nagaan: het inspannings-ecg kan een aanwijzing geven van ischemie.
- Stressechocardiografie kan eveneens ischemie aantonen, maar bovendien de vitaliteit van het myocardweefsel nagaan.
- Hartkatheterisatie moet worden overwogen als men de oorzaak van hartfalen wil nagaan en als men revascularisatie overweegt. Momenteel is echter niet duidelijk of deze interventie (PCI/CABG) bij patiënten met hartfalen en ischemie voordelen heeft ten opzichte van medicamenteuze anti-ischemische behandeling. Observationele onderzoeken suggereren dat revascularisatie zou kunnen leiden tot symptomatische verbetering en tot verbetering van de hartfunctie [Schinkel 2007; Owan 2006; Gheorghiade 2006], en er is een gerandomiseerd onderzoek gaande naar het effect van revascularisatie op klinische uitkomsten [Shanmugam 2008].
- Coronairangiografie moet worden overwogen bij patiënten met hartfalen en inspanningsgebonden angina pectoris, na een hartstilstand, bij patiënten met ernstig acuut hartfalen (shock of acuut longoedeem) en bij patiënten die niet goed reageren op medicamenteuze behandeling. Ook bij patiënten die in aanmerking komen voor aorta- of mitralisklepchirurgie biedt coronairangiografie de mogelijkheid om eventueel belangrijk coronarialijden ook invasief te benaderen.
- Noot 21.↲
Therapietrouw Zowel niet-medicamenteuze als medicamenteuze interventies kunnen de morbiditeit en de mortaliteit van patiënten met hartfalen verminderen en leiden tot een betere kwaliteit van leven [Granger 2005]. Uit de literatuur blijkt dat slechts 20-60% van de patiënten met hartfalen de niet-medicamenteuze adviezen opvolgt. Ook de medicatie wordt vaak niet op de juiste wijze gebruikt [Evangelista 2000; Van der Wal 2005]. Uit de Euro Heart Failure Survey blijkt dat veel patiënten de adviezen verkeerd interpreteren of zich niet kunnen herinneren dat zij adviezen hadden gekregen over zelfzorg, bijvoorbeeld dieetinstructies [Lainscak 2007].
- Noot 22.↲
Zelfzorgitems en symptoomherkenning [Jaarsma 2003] De symptomen van verslechtering van hartfalen kunnen sterk uiteenlopen [Ekman 2005; Patel 2007]. Patiënten, familie en hulpverleners moeten tekenen van verslechterend hartfalen kunnen herkennen en daaraan de juiste consequenties leren verbinden, zoals het aanpassen van de dosis diuretica of het inwinnen van medisch advies. Tijdelijk verhogen of verlagen van de dosis diuretica is mogelijk binnen een tevoren afgesproken dosisgebied, gebaseerd op symptomen en eventuele bekende of voorspelbare vochtbalansproblemen (snel toegenomen lichaamsgewicht, overmatige natriuminname, diarree, braken, koorts, warm weer, enzovoort). Bij een flexibel diureticabeleid moeten wel regelmatige controles van labwaarden (natrium, kalium, berekende creatinineklaring) worden afgesproken. Patiënten moeten zich ervan bewust zijn dat ook zonder gewichtstoename een verslechtering van hartfalen kan optreden die aanpassing van de behandeling noodzakelijk maakt [Lewin 2005]. Psychische stoornissen zoals depressie en angststoornissen kunnen een negatieve invloed hebben op de zelfzorgcapaciteit [Schiffer 2007]. Bij een gewichtstoename van meer dan 2 kg in drie dagen, toenemende vermoeidheid, toenemende kortademigheid, vasthouden van vocht of vaker (’s nachts) moeten plassen, moet de patiënt contact opnemen met de behandelaar.
- Noot 23.↲
Natrium en kalium Er is geen evidentie uit onderzoek voor beperking van de maximale dagelijkse natriuminname bij hartfalen. Toch wordt – op empirische gronden – enige mate van natriumbeperking aanbevolen bij hartfalen, evenals terughoudend zijn met kant-en-klare voeding (inclusief soepen). Een diëtist kan hierover praktische individuele adviezen verstrekken. Bij een natriumbeperkt dieet kan men zoutvervangende producten gebruiken. Deze bevatten echter vaak kalium. Dat kan, bij het gebruik van kaliumsparende diuretica in combinatie met ACE-remmers, AII-antagonisten of aldosteronantagonisten, leiden tot hyperkaliëmie. Een serumkaliumwaarde > 5,5 mmol/l is een contra-indicatie voor het gebruik van zoutvervangende mineralenmengsels op basis van kalium.
- Noot 24.↲
Vochtinname Bij gebruik van hoge doses diuretica lijkt extra vochtbeperking niet zinvol te zijn [Paterna 2009; Travers 2007]. Anderzijds wordt in de praktijk extra drinken nog wel eens aanbevolen aan patiënten die diuretica gebruiken. Dit is onjuist. In geval van klinische vochtretentie met hyponatriëmie (hypervolemische of verdunningshyponatriëmie) gelden de volgende regels:
- bij een plasmaconcentratie < 130 mmol/l tijdelijk een beperking van vocht tot 1500 ml per 24 uur;
- bij een plasmaconcentratie < 125 mmol/l tijdelijk een vochtbeperking tot 1200 ml per 24 uur [Nederlandse Internisten Vereniging 2005].
Normo- of hypovolemische hyponatriëmie is veelal een bijwerking van hoge doseringen diuretica. Naast andere maatregelen kan ook dan vochtbeperking nodig zijn (zie ook de paragraaf Diuretica, onder Bijwerkingen).
- Noot 25.↲
Effect van n-3-meervoudig onverzadigde vetzuren bij patiënten met chronisch hartfalen Omega-3-vetzuren kunnen als medicamenteuze behandeling worden toegepast of worden beschouwd als een aanvulling op het onder gezonde voeding vallende advies tot het eten van meer vette vis. Het GISSI-HF-onderzoek is een dubbelblinde, placebogecontroleerde trial (n = 6975) naar het effect van dagelijks gebruik van n-3-meervoudig onverzadigde vetzuren. Uitkomsten waren ‘totale sterfte’ en ‘sterfte of ziekenhuisopname wegens cardiovasculaire aandoening’. Er werd een klein verschil gevonden voor beide uitkomsten ten gunste van de groep die n-3-meervoudig onverzadigde vetzuren gebruikte. Overigens werden de resultaten pas significant na ‘adjustment confounders’, hetgeen bij gerandomiseerde trials van deze omvang niet gebruikelijk is en de randomisatie geweld aandoet [Tavazzi 2008].
- Noot 26.↲
Alcohol Alcohol kan een negatief inotroop effect hebben. Ook bloeddrukstijging en aritmieën kunnen het gevolg zijn. Overmatig alcoholgebruik kan hartfalen zeer nadelig beïnvloeden [Nicolas 2002].
- Noot 27.↲
Gewichtsreductie Er is geen bewijs dat gewichtsreductie bij hartfalen leidt tot een betere prognose of minder symptomen. Wel is bekend dat afvallen bij obese patiënten met hartfalen kan leiden tot afname van symptomen en verbetering van de kwaliteit van leven. Tevens kan gewichtsvermindering bij deze patiënten leiden tot vermindering van slaapapneu [Alpert 1997; Mariotti 2008; Nicklas 2006]. Bij matig en ernstig hartfalen wordt afvallen niet routinematig geadviseerd, omdat bij verdere progressie van hartfalen ongewild gewichtsverlies en anorexie veel voorkomen.
- Noot 28.↲
Cachexie Onbedoeld gewichtsverlies komt veel voor bij patiënten met ernstig hartfalen. De pathofysiologie van cachexie bij hartfalen is complex en nog niet geheel duidelijk. Verminderde voedselinname (ondervoeding), malabsorptie door veneuze stuwing van het maag-darmkanaal, gestoorde stofwisseling, chronische ontsteking, hormoonresistentie, neurohormonale ontregeling en verminderde anabole stofwisseling zijn van invloed [Anker 1997; Anker 2003; Springer 2006; Von Haehling 2007]. Het effect van dieetsupplementen en eetlustbevorderende farmacotherapie is niet onderzocht. Cachexie bij hartfalen is een belangrijke negatieve prognostische factor [Anker 1997; Anker 2003].
- Noot 29.↲
Lichaamsbeweging, conditietraining en hartrevalidatie Bij hartfalen is lichaamsbeweging in het algemeen gunstig. Regelmatige duur- en krachttraining kan een gunstig effect hebben op autonome zenuwfuncties, spierkracht, vaatwand- en endotheelfunctie, en kan oxidatieve stress doen verminderen. Het gerandomiseerde ACTION-HF-onderzoek onder 2331 patiënten met hartfalen toonde een lichte verbetering (ongeveer 10%) op de gecombineerde primaire uitkomst ‘sterfte + ziekenhuisopname’ in de groep die actief begeleid werd met een trainingsprogramma ten opzichte van de ‘usual care’-groep. Van de secundaire uitkomsten was ‘cardiovasculaire sterfte + ziekenhuisopname’ ook ongeveer 10% verbeterd in de actieve groep ten opzichte van de gebruikelijke zorg. Statistische significantie werd alleen bereikt na correctie voor prognostische variabelen [Flynn 2009; O’Connor 2009; Whellan 2007]. Enkele systematische reviews en meta-analyses hadden eerder al aannemelijk gemaakt dat conditietraining bij patiënten met hartfalen de mortaliteit en de kans op hospitalisatie doet afnemen en de inspanningstolerantie en de kwaliteit van leven doet toenemen [Anonymus 2001a; Kujala 2004; Piepoli 1998; Piepoli 2004; Rees 2004; Smart 2004]. In een recente Nederlandse meta-analyse werd ook gevonden dat fysieke training een gunstig effect heeft op het inspanningsvermogen en de kwaliteit van leven. Het effect op sterfte werd hierbij niet onderzocht [Van Tol 2006]. Hartrevalidatieprogramma’s bij hartfalen vormen een mogelijkheid om gestructureerd conditietraining aan te bieden [Revalidatie Commissie van de Nederlandse Vereniging Voor Cardiologie en de Nederlandse Hartstichting 2004].
- Noot 30.↲
Seksuele activiteit Seksuele disfunctie komt veel voor bij patiënten met cardiovasculaire ziekten en wordt met name veroorzaakt door bijwerkingen van geneesmiddelen, psychologische factoren, vermoeidheid en depressie. Er is weinig onderzoek verricht naar de risico’s of mogelijk gunstige effecten van seksuele activiteit bij patiënten met hartfalen. Een licht verhoogd risico op decompensatie na seksuele activiteit bij patiënten in NYHA-klasse III-IV is wel gerapporteerd [Kostis 2005]. Symptomen zoals dyspneu, palpitaties of angina pectoris kunnen in zeldzame gevallen optreden, terwijl hiervan bij een vergelijkbaar niveau van niet-seksueel gebonden lichamelijke inspanning geen sprake is. Profylactisch gebruik van nitroglycerine sublinguaal kan dan worden overwogen. Fosfodiësterase-5-remmers kunnen worden voorgeschreven aan patiënten met hartfalen, tenzij zij nitraten gebruiken.
- Noot 31.↲
Vliegen en verblijf op hoogte en in de (sub)tropen In een vliegtuig komt de cabinedruk overeen met de luchtdruk op een hoogte van ongeveer 2000 m. Omdat de reisduur meestal beperkt is, er geen lichamelijke inspanning nodig is en er zo nodig altijd direct zuurstof beschikbaar is, is vliegen verantwoord. Kortdurend verblijf op 2000 m is voor patiënten met hartfalen waarschijnlijk geen probleem. Wel wordt geadviseerd op lagere hoogte te overnachten en in alle gevallen goed te acclimatiseren. In een warm en/of vochtig klimaat moeten in verband met de kans op extra vochtverlies de vochtbeperking en de dosering diuretica en/of vaatverwijders worden aangepast. Verblijf op grote hoogte (> 1500 m) en reizen naar zeer warme en vochtige gebieden zou aan niet geheel klachtenvrije patiënten met hartfalen ontraden moeten worden.
- Noot 32.↲
Slaapstoornissen Patiënten met symptomatisch hartfalen hebben frequent slaapgerelateerde ademhalingsstoornissen zoals cheyne-stokesademhaling of centrale of obstructieve slaapapneu. Recent onderzoek liet zien dat bij maar liefst 50% van de patiënten met een LVEF < 40% een slaapapneu kon worden aangetoond [Oldenburg 2007]. Sommige van deze stoornissen zijn geassocieerd met een verhoogde mortaliteit en morbiditeit [Corra 2005; Naughton 2005]. Met name een obstructief slaapapneusyndroom (OSAS) [Wang 2007] en een centraal slaapapneusyndroom (CSAS) [Javaheri 2007] lijken geassocieerd te zijn met een slechtere prognose en verhoogde morbiditeit. In een gerandomiseerd onderzoek (n = 258) met een follow-up van twee jaar is het effect van behandeling gedurende de nacht met ‘continuous positive airway pressure’ onderzocht. De nachtelijke oxygenatie en de ejectiefractie verbeterden, maar niet de overleving [Bradley 2005].
- Noot 33.↲
Autorijden In de Regeling eisen geschiktheid 2000 heeft het Ministerie van Verkeer en Waterstaat bepaald dat patiënten in NYHA-klasse III en IV ongeschikt zijn voor ieder rijbewijs [Ministerie van Verkeer en Waterstaat 2000]. Dit advies is tien jaar geleden gegeven en is voor wat betreft patiënten in NYHA-klasse III onvoldoende onderbouwd. De werkgroep is van mening dat bij patiënten in NYHA-klasse III op individueel niveau beoordeeld zou moeten worden of ze wel of niet geschikt zijn voor het besturen van een auto. Patiënten in NYHA-klasse IV met klachten in rust zijn in principe ongeschikt voor het besturen van een auto omdat bij hen vaak sprake is van concentratiestoornissen, vermoeidheid en dyspneu.
- Noot 34.↲
ACE-remmers bij hartfalen Behandeling met ACE-remmers verlengt de verwachte overleving en doet de klachten afnemen, evenals de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen.
Klinisch onderzoek
- In twee grote klinische onderzoeken (CONSENSUS en SOLVD-Treatment), die in totaal 2800 patiënten includeerden met mild tot ernstig systolisch hartfalen, is het effect van enalapril vergeleken met placebo [Anonymus 1987; Anonymus 1991]. De meeste patiënten werden tevens behandeld met een diureticum en digoxine en ongeveer 10% kreeg daarnaast een bètablokker. In het CONSENSUS-onderzoek, waarin patiënten met ernstig hartfalen waren geïncludeerd, gebruikte 53% tevens spironolacton. Beide onderzoeken toonden dat behandeling met een ACE-remmer de mortaliteit deed afnemen: de relatieve risicoreductie (RRR) was 27% in CONSENSUS en 16% in SOLVD-Treatment. In het SOLVD-Treatment-onderzoek was er tevens een reductie van 26% van het aantal ziekenhuisopnames wegens verslechterend hartfalen.
- De absolute risicoreductie (ARR) van mortaliteit bij patiënten met mild of matig hartfalen was 4,5% (SOLVD-Treatment), hetgeen overeenkomt met een number needed to treat (NNT) van 22, nodig om één dood door hartfalen uit te stellen over een periode van 41 maanden. Voor ernstig hartfalen (CONSENSUS) bedroeg de ARR 14,6% en de NNT 7 over een periode van 6 maanden.
- In het ATLAS-onderzoek werden 3164 patiënten met matig tot ernstig hartfalen geïncludeerd en gerandomiseerd naar een lage of hoge dosis lisinopril. De RRR voor de gecombineerde uitkomst ‘dood of ziekenhuisopname wegens hartfalen’ bedroeg 15% in het voordeel van hoge dosis lisinopril [Packer 1999].
- Aanvullend bewijs voor het gunstige effect van ACE-remmers komt uit een onderzoek bij patiënten met een verminderde LVEF zonder symptomen van hartfalen (asymptomatische linkerventrikeldisfunctie) en uit drie grote placebogecontroleerde onderzoeken bij in totaal 5966 patiënten na een acuut myocardinfarct met hartfalen of systolische linkerventrikeldisfunctie [McMurray 2005]. In het SOLVD-Prevention onderzoek (4228 patiënten met asymptomatische linkerventrikeldisfunctie) werd 20% RRR gevonden voor ‘dood of ziekenhuisopname wegens hartfalen’. In de post-myocardinfarctonderzoeken die gebruik maakten van captopril (SAVE), ramipril (AIRE), en trandolapril (TRACE) vond men respectievelijk 26% RRR voor dood en 27% voor ‘dood of ziekenhuisopname wegens hartfalen’. Van ACE-remmers is aangetoond dat ze het risico van een myocardinfarct verkleinen bij patiënten met en zonder hartfalen en onafhankelijk van de LVEF [Anonymus 1993; Kober 1995; Pfeffer 1992].
- Noot 35.↲
Diuretica Ontwatering met diuretica geeft verlichting van de symptomen bij pulmonale en systemische veneuze stuwing (overvulling). Hoewel het bewijs dat ook de mortaliteit wordt gereduceerd buitengewoon schaars is, is dit wel aannemelijk [Faris 2002]. Diuretica kunnen echter het RAAS-systeem activeren, en theoretisch kan dit negatieve effecten hebben op het hartfalen. Daarom is het gebruikelijk diuretica te combineren met ACE-remmers of AII-antagonisten. Bij licht hartfalen (NYHA-klasse II) kan soms worden volstaan met een thiazidediureticum, mits de nierfunctie normaal is. Bij matig tot ernstig hartfalen (NYHA-klasse III en IV) zal meestal een lisdiureticum nodig zijn. Zeer hoge doses diuretica kunnen nierschade geven en ototoxisch zijn. Aldosteronantagonisten verdienen bij hartfalen altijd de voorkeur boven andere kaliumsparende diuretica. Bij diureticaresistentie door secundair hyperaldosteronisme kunnen zij worden toegevoegd om het diuretisch effect van de andere diuretica te versterken. Individuele dosisaanpassingen afhankelijk van vochtretentie (dagelijkse evaluatie van lichaamsgewicht en andere tekenen van vochtretentie) zijn gebruikelijk. Geef geen thiazides bij een creatineklaring < 30 ml/min., uitgezonderd de synergistische toepassing in de combinatie met een lisdiureticum om diureticaresistentie te doorbreken.
- Noot 36.↲
Bètablokkers Behandeling met een bètablokker verlengt de verwachte overleving en doet de klachten afnemen, evenals de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen.
Klinisch onderzoek
- Naar de effecten van bètablokkers bij hartfalen is meer klinisch onderzoek gedaan dan naar de effecten van ACE-remmers. In drie grote onderzoeken werden bijna 9000 patiënten met mild tot ernstig hartfalen gerandomiseerd naar een placebo of een bètablokker (bisoprolol, carvedilol of metoprololsuccinaat met vertraagde afgifte) [Anonymus 1999a; Anonymus 1999b; Packer 2002]. Meer dan 90% gebruikte al een ACE-remmer of AII-antagonist en een diureticum, en meer dan 50% digoxine. Elk van de bovengenoemde drie onderzoeken toonde een sterftereductie (RRR 34%) en een vermindering van ziekenhuisopnames wegens verslechterend hartfalen (RRR 28-36%) binnen één jaar na de start van de behandeling. In twee onderzoeken was er ook een verbetering van de score voor kwaliteit van leven [Hjalmarson 2000; Packer 2002]. De absolute sterftereductie na één jaar behandeling bedroeg bij patiënten met mild tot matig ernstig hartfalen 4,3%, overeenkomend met een NNT van 23. De corresponderende getallen voor ernstig hartfalen [Packer 2002] waren ARR 7,1% en een NNT van 14.
- Deze bevindingen worden gesteund door de resultaten van het SENIORS-onderzoek, een gerandomiseerde trial onder 2128 ouderen met een gemiddelde leeftijd van 70 jaar [Flather 2005]. Van deze groep had 36% een LVEF < 35%. Behandeling met nebivolol gaf een RRR van 14% op de primaire uitkomst ‘dood of ziekenhuisopname wegens een cardiovasculaire indicatie’.
- Bovengenoemde bevindingen worden gesteund door onderzoek van oudere datum [Cohn 1997], door meta-analyses van kleinere onderzoeken met bètablokkers en door een placebogecontroleerd post-myocardinfarctonderzoek onder 1959 patiënten met een LVEF ? 40%. In laatstgenoemd onderzoek werd met carvedilol een sterftereductie (RRR) bereikt van 23% tijdens een gemiddelde follow-up van 1,3 jaar [Packer 2001].
- Eén groot gerandomiseerd onderzoek met bucindolol toonde geen significante sterftereductie maar de trend van de bevindingen kwam wel overeen met de bovengenoemde onderzoeken [Anonymus 2001b].
- In het COMET-onderzoek werd aangetoond dat carvedilol qua sterftereductie effectiever was dan metoprololtartraat (dit in afwijking van het langwerkende metoprololsuccinaat-retard in het MERIT-HF onderzoek) [Poole-Wilson 2003].
- Noot 37.↲
Aldosteronantagonisten Behandeling met spironolacton verlengt de overleving en vermindert de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen, indien toegevoegd aan de basisbehandeling met een ACE-remmer en een bètablokker.
Klinisch onderzoek
- In een groot gerandomiseerd onderzoek (RALES, 1663 patiënten) naar het effect van spironolacton 25-50 mg 1dd bij patiënten met ernstig hartfalen (LVEF ? 35% en NYHA-klasse III, en tevens gedurende het laatste half jaar een periode in NYHA-klasse IV) werd een sterftereductie gevonden van 35% (RRR) en een reductie in ziekenhuisopnames wegens verslechterend hartfalen van 35% (RRR) in een tijdvak van twee jaar na de start met spironolacton. Ook het gemiddelde indelingsniveau in NYHA-klasse verbeterde. De ARR van sterfte bedroeg 11,4%, overeenkomend met een NNT van 9 (108). De patiënten in dit onderzoek gebruikten veelal als onderhoudsmedicatie diuretica, ACE-remmers en digoxine. Bètablokkers waren toentertijd nog niet gebruikelijk (11% van de patiënten) [Pitt 1999].
- Deze bevindingen worden ondersteund door een post-myocardinfarctonderzoek (EPHESUS) waarin 6632 patiënten werden geïncludeerd binnen drie tot veertien dagen na hun infarct, mits met een LVEF ? 40% en tevens hartfalen of diabetes mellitus [Pitt 2003]. De patiënten werden gerandomiseerd toegewezen aan de eplerenongroep (25-50 mg) of de placebogroep. De reeds bestaande onderhoudsmedicatie bestond onder andere uit ACE-remmers/AII-antagonisten (87%) en bètablokkers (75%). Het resultaat was een sterftereductie van 15% (RRR).
- De bijwerkingen hyperkaliëmie en nierfunctieverslechtering waren in beide onderzoeken zeldzaam maar kunnen in de praktijk vaker voorkomen, vooral bij ouderen [Juurlink 2004].
- Noot 38.↲
Angiotensine-II-receptorblokkers Behandeling met AII-antagonisten doet de klachten afnemen, evenals de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen, en verbetert de ventrikelfunctie. De kans op cardiovasculaire mortaliteit wordt verkleind.
Klinisch onderzoek
- In twee grote gerandomiseerde onderzoeken (Val-HEFT en CHARM-Added) werden ongeveer 7600 patiënten geïncludeerd met mild tot ernstig hartfalen. Een AII-antagonist (valsartan of candesartan) of een placebo werd toegevoegd aan de medicatie waarvan een ACE-remmer reeds deel uitmaakte [Cohn 2001; McMurray 2003]. Een bètablokker werd al door 35-55% gebruikt en spironolacton door 5-17%. Het resultaat was een reductie van ziekenhuisopnames wegens verslechterend hartfalen van 17-24% (RRR). Alleen in CHARM-Added werd ook een sterftereductie gevonden (RRR 16%). Er werd geen reductie gevonden in het totaal aantal ziekenhuisopnames (ongeacht de indicatie).
- In twee gerandomiseerde onderzoeken (VALIANT en OPTIMAAL) werd de effectiviteit van captopril vergeleken met AII-antagonisten. In VALIANT bleek valsartan minstens gelijkwaardig aan captopril maar in OPTIMAAL kon gelijkwaardigheid van losartan aan captopril niet worden aangetoond [Dickstein 2002; McMurray 2004; Pfeffer 2003].
- CHARM-Alternative was een placebogecontroleerd gerandomiseerd onderzoek naar het effect van candesartan bij 2028 patiënten met een LVEF ? 40%, die een ACE-remmer niet verdroegen [Granger 2003]. Men vond een RRR van 23% op de gecombineerde uitkomst ‘cardiovasculaire dood of ziekenhuisopname wegens verslechterend hartfalen’ (ARR 7% in 34 maanden).
- Noot 39.↲
Digoxine Digoxine toegevoegd aan een ACE-remmer verkleint de kans op ziekenhuisopname wegens verslechterend hartfalen en verbetert de klachten. Er is geen toename van de verwachte overlevingsduur.
Digoxine bij hartfalen met atriumfibrilleren
- Bij gedecompenseerde patiënten is digoxine een goede keuze als initieel middel ten behoeve van ‘rate control’. Bij systolisch hartfalen geniet, na stabilisering van de patiënt, een bètablokker de voorkeur.
- Voor ‘rate control’ kan digoxine zo nodig worden toegevoegd aan een bètablokker.
- In rust geeft digoxine veelal voldoende ‘rate control’ (< 80/min.), maar bij inspanning is dat vaak niet het geval.
- Verapamil of diltiazem, al dan niet in combinatie met digoxine, komen alleen in aanmerking voor patiënten met een LVEF > 40%.
Digoxine bij systolisch hartfalen en een sinusritme
- Er is één groot gerandomiseerd onderzoek (DIG) naar het effect van digoxine bij patiënten met systolisch hartfalen en een sinusritme [Anonymus 1997b]. De onderzoekers includeerden 6800 patiënten met systolisch hartfalen in NYHA-klasse II-IV. Digoxine 0,25 mg, toegevoegd aan de bestaande onderhoudsmedicatie van diuretica en ACE-remmers, gaf geen sterftereductie vergeleken met placebo, maar wel een vermindering in ziekenhuisopnames wegens verslechterend hartfalen van 28% (RRR) gedurende de drie jaar follow-up. De ARR bedroeg 7,9%, overeenkomend met een NNT van 13. De kwaliteit van leven verbeterde niet aantoonbaar en er was geen effect bij patiënten met diastolisch hartfalen [Lader 2003]. In een recente post-hocanalyse is enige sterftereductie gevonden in een subgroep ouderen [Ahmed 2009].
- Noot 40.↲
Hydralazine + isosorbidedinitraat (H-ISDN) Toevoeging van H-ISDN moet worden overwogen bij patiënten van Afrikaanse afkomst die symptomatisch blijven ondanks behandeling met een ACE-remmer, diureticum, bètablokker en een aldosteronantagonist of AII-antagonist. Behandeling met H-ISDN verlengt bij deze patiënten de verwachte overlevingsduur en de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen.
Klinisch onderzoek Er zijn één gerandomiseerd vergelijkend onderzoek (tussen H-ISDN en enalapril) [Cohn 1991] en twee placebogecontroleerde onderzoeken (V-HeFT-I en A-HeFT).
- In V-HeFT-I werden 642 mannen verdeeld over drie groepen: H-ISDN, prazosine en placebo [Loeb 1993]. ACE-remmers waren destijds nog niet beschikbaar en bètablokkers werden nog niet toegepast bij hartfalen. De sterfte in de prazosinegroep was gelijk aan die in de placebogroep, maar in de H-ISDN-groep werd een sterftereductie gevonden van 22% (RRR) in 2,3 jaar. De ARR bedroeg 5,3%, overeenkomend met een NNT van 19.
- In A-HeFT werden 1050 Afro-Amerikaanse mannen en vrouwen met hartfalen NYHA-klasse III of IV geïncludeerd [Taylor 2004]. H-ISDN of placebo werd gerandomiseerd toegevoegd aan de medicatie die reeds bestond uit diuretica (90%), ACE-remmers (70%), AII-antagonisten (17%), bètablokkers (74%) en spironolacton (39%). Dit onderzoek werd voortijdig beëindigd na gemiddeld tien maanden follow-up wegens een significante sterftereductie (RRR 43%, ARR 4%, NNT 25). Ook het risico van ziekenhuisopname verminderde (RRR 33%) en de kwaliteit van leven nam toe.
- In V-HeFT-II werd H-ISDN vergeleken met enalapril bij 804 mannen met hartfalen NYHA-klasse II en III. Enalapril bleek effectiever.
- De meest gerapporteerde bijwerkingen in deze onderzoeken waren hoofdpijn, duizeligheid (door hypotensie) en misselijkheid. Gewrichtspijn leidend tot staken van de medicatie kwam voor in 5-10% van de patiënten in V-HeFT-I en -II. Persisterende hoge waarden voor antinucleaire factoren (ANF) werden gevonden bij 2-3% van de patiënten. De diagnose lupus erythematodes (SLE) werd evenwel zelden gesteld.
- Noot 41.↲
Therapie bij diastolisch hartfalen Het aantal onderzoeken bij mensen met diastolisch hartfalen is beperkt. De werkgroep baseert zijn adviezen op die van de Multidisciplinaire richtlijn Hartfalen 2010 en de ESC-richtlijn Hartfalen. Deze houden in dat er goede bloeddrukbehandeling moet zijn en in geval van tachycardie medicamenteuze verlaging van de hartfrequentie. Bij klachten passend bij overvulling of klinische tekenen daarvan worden diuretica geadviseerd. Op theoretische gronden (het probleem bij diastolisch hartfalen is vooral relaxatie in de diastole) moet de dosering van diuretica zo laag mogelijk zijn om ondervulling (en daarmee volumeaanbod aan de linker ventrikel) te voorkomen. De CHARM-preserved trial (n = 3023) toonde geen significant effect van candesartan op de gecombineerde uitkomst ‘cardiovasculaire mortaliteit + ziekenhuisopnames wegens hartfalen’. Wel was er een significant effect op de uitkomst ‘ziekenhuisopnames wegens hartfalen’ [Yusuf 2003]. In het PEP-CHF-onderzoek (n = 850) werd van perindopril over de totale onderzoeksperiode geen reductie aangetoond op de gecombineerde primaire uitkomst ‘cardiovasculaire mortaliteit + ziekenhuisopnames wegens hartfalen’. Wel was er na één jaar een significant verschil ten gunste van perindopril [Cleland 2006]. In het I-PRESERVE-onderzoek (n = 4161), waarin meer ouderen en meer vrouwen werden ingesloten dan in de beide eerdergenoemde onderzoeken, werd eveneens geen gunstig effect gevonden van behandeling met irbesartan [Massie 2008]. Hierbij dient opgemerkt te worden dat een aanzienlijk aantal patiënten reeds ACE-remmers, bètablokkers of spironolacton gebruikte, en dat uit dit onderzoek niet mag worden geconcludeerd dat remming van het RAAS-systeem in het algemeen geen effect zou hebben bij diastolisch hartfalen.
- Noot 42.↲
Antistolling en plaatjesaggregatieremmers bij hartfalen Hiervoor wordt ook verwezen naar de NHG-Standaard Atriumfibrilleren. Bij hartfalen met atriumfibrilleren reduceren plaatjesaggregatieremmers en cumarines het risico op trombo-embolieën. Cumarines reduceren bij patiënten met atriumfibrilleren het risico op een CVA met 60-70% [Mosterd 2007]. Orale anticoagulantia worden ook aanbevolen wanneer met beeldvormend onderzoek een intracardiale trombus is aangetoond of wanneer er aanwijzingen zijn voor embolieën in de systemische circulatie. Plaatjesaggregatieremmers zijn minder effectief [Cleland 2004]. Het absolute risico op een trombo-embolie bepaalt de keuze van antitrombotische behandeling: bij een jaarlijks risico < 4% wordt acetylsalicylzuur geadviseerd, bij een jaarlijks risico ? 4% een cumarinederivaat. Bij een reumatische mitralisklepstenose en/of een eerdere arteriële trombo-embolie (zoals een CVA) is het risico altijd ? 4%. De CHADS2-scorelijst is een hulpmiddel om het risico te schatten: hartfalen geeft 1 punt en hypertensie, diabetes of leeftijd > 75 jaar geven eveneens 1 punt. Bij 2 of meer punten verdienen cumarines de voorkeur, tenzij er een contra-indicatie bestaat zoals diastolische bloeddruk > 110 mmHg, recente ernstige bloeding, lever- of nierinsufficiëntie of hemorragische diathese [Boode 2009; Fang 2008; Lip 2006; Gage 2004]. Jaarlijkse herbeoordeling van het risico op trombo-embolie is gewenst.
- Noot 43.↲
Statines In de meeste onderzoeken naar de effecten van statines werden patiënten met hartfalen uitgesloten. In het CORONA-onderzoek werd het effect van rosuvastatine bij systolisch hartfalen met een ischemische etiologie onderzocht. Er was geen effect op de primaire uitkomst ‘cardiovasculaire dood, hartinfarct of CVA’ en evenmin op sterfte. Alleen het aantal ziekenhuisopnames wegens cardiovasculaire indicaties verminderde [Kjekshus 2007]. Ook in GISSI-HF, een gerandomiseerd onderzoek met een looptijd van vier jaar naar de effectiviteit van statines bij hartfalen, werd geen effect gevonden van rosuvastatine op de gecombineerde uitkomst ‘sterfte of hospitalisatie’ om cardiovasculaire redenen [Tavazzi 2008].
- Noot 44.↲
Devices, percutane behandeling en chirurgie Afhankelijk van de onderliggende pathologie kunnen de volgende behandelingen worden toegepast.
- Revascularisatie bij patiënten met hartfalen. Coronaire hartziekte is de meest voorkomende oorzaak van systolisch hartfalen. Bij diastolisch hartfalen komt coronarialijden minder vaak voor, maar het kan nog steeds bij de helft van deze patiënten worden aangetoond. Zowel coronaire bypasschirurgie (CABG) als een percutane coronaire interventie (PCI) moeten worden overwogen bij patiënten met hartfalen en coronarialijden. Er zijn geen gegevens van multicenteronderzoeken naar de waarde van revascularisatieprocedures voor het verbeteren van de symptomen van hartfalen. Observationele singlecenteronderzoeken naar hartfalen met ischemische oorzaak suggereren echter dat revascularisatie zou kunnen leiden tot symptomatische verbetering en mogelijk de hartfunctie verbetert [Gheorghiade 2006; Lloyd-Jones 2002; Owan 2006; Schinkel 2007]. Er zijn klinische studies gaande naar het effect van een revascularisatie-ingreep op de klinische uitkomsten [Shanmugam 2008].
- Klepchirurgie. Hartklepgebreken kunnen een onderliggende oorzaak zijn van hartfalen. Chirurgie kan worden overwogen in symptomatische patiënten met significante klepgebreken en een slechte linkerventrikelfunctie. De beslissing tot chirurgisch ingrijpen bij een hemodynamisch significante aortastenose, aortainsufficiëntie of mitralisinsufficiëntie vereist zorgvuldige afweging van de motivatie van de patiënt, diens biologische leeftijd en het risicoprofiel. Doorgaans verbetert de linkerventrikelfunctie na chirurgie, en één gerandomiseerd onderzoek liet een verbeterde overleving zien in vergelijking met controles [Pereira 2002]. Daar staat tegenover dat het risico van chirurgie het hoogst is bij patiënten met de meest gevorderde linkerventrikeldisfunctie [Vahanian 2007].
- Pacemakers. De gebruikelijke indicaties voor patiënten met normale linkerventrikelfunctie zijn eveneens van toepassing op patiënten met hartfalen. In het bijzonder bij patiënten met hartfalen en sinusritme lijkt het behoud van een normale chronotrope respons en coördinatie van atriale en ventriculaire contractie met een pacemaker belangrijk.
- Cardiale resynchronisatietherapie (CRT). Cardiale resynchronisatietherapie met pacemakerfunctie (CRT-P) wordt aanbevolen om de morbiditeit en mortaliteit te reduceren in een selecte groep patiënten in NYHA-klasse IIII-IV, die ondanks optimale medicamenteuze therapie een verminderde ejectiefractie (LVEF ? 35%) en een verbreed QRS-complex (QRS ? 120 msec) hebben. CRT wordt gebruikt om de interventriculaire en intraventriculaire contractie te synchroniseren. In dezelfde groep patiënten kan er ook een indicatie bestaan voor CRT met defibrillatorfunctie (CRT-D). In het COMPANION-onderzoek [Bristow 2004] waren zowel CRT-P als CRT-D geassocieerd met 20% reductie van de primaire gecombineerde uitkomst: alle mortaliteit en alle hospitalisatie (p < 0,01). CRT-D was geassocieerd met een significante daling van de totale mortaliteit (p = 0,003), maar CRT-P niet (p = 0,059). Het is belangrijk hierbij op te merken dat dit onderzoek niet was opgezet om de effecten op de totale mortaliteit te onderzoeken, noch om CRT-P en CRT-D te vergelijken. Er zijn geen onomstotelijke data beschikbaar om de effecten van CRT-P en CRT-D te kunnen vergelijken. In het CARE-HF-onderzoek [Cleland 2005] was CRT-P geassocieerd met een significante reductie van 37% van de samengestelde uitkomst van totale dood en hospitalisatie voor grote cardiovasculaire gebeurtenissen (p < 0,001) en een reductie van 36% van de totale mortaliteit (p < 0,002). Een recente meta-analyse liet zien dat de reductie in ‘all cause’-mortaliteit 29% was [Rivero-Ayerza 2006]. Daarbij moet wel worden opgemerkt dat deze meta-analyse er niet in slaagde aan te tonen dat CRT-D de overleving verbeterde in vergelijking met ICD-therapie (RR 0,82; 95%-BI 0,57-1,18) of alleen resynchronisatie (CRT-P) (RR 0,85; 95%-BI 0,60-1,22). De concentraties natriuretisch peptide zijn sterke indicatoren voor een verhoogd cardiovasculair risico. CRT reduceert (NT-pro)BNP aanzienlijk, en een afname van (NT-pro)BNP is geassocieerd met een betere uitkomst [Fruhwald 2007]. Het voordeel in overleving van CRT-D ten opzichte van CRT-P is niet adequaat onderzocht. Dankzij de gedocumenteerde effectiviteit van ICD-therapie bij de preventie van plotselinge hartdood wordt in de klinische praktijk in het algemeen de voorkeur gegeven aan een CRT-D bij patiënten die voldoen aan de CRT-criteria, waaronder een levensverwachting met goede kwaliteit van leven van meer dan een jaar.
- Interne cardiale defibrillator (ICD). Ongeveer de helft van de sterfgevallen onder patiënten met hartfalen is gerelateerd aan plotselinge hartdood. Een verlaging van de proportie patiënten die overlijden aan een aritmie is daarom een belangrijk onderdeel van de inspanning ter vermindering van de totale mortaliteit in deze populatie. ICD is met name geïndiceerd voor secundaire preventie bij patiënten met hartfalen na ventrikelfibrilleren. Er zijn geen onderzoeken uitgevoerd naar de populatie die een hartstilstand met een niet-ischemische etiologie heeft overleefd. ICD-therapie voor primaire preventie wordt aanbevolen om de mortaliteit te verlagen van patiënten met linkerventrikeldisfunctie ten gevolge van een myocardinfarct en van patiënten met niet-ischemische cardiomyopathie. Klinische post-myocardinfarctonderzoeken in patiënten die een hartstilstand hebben overleefd, hebben laten zien dat het gebruik van een ICD effectiever is dan antiaritmische medicatie bij de preventie van plotselinge hartdood [Anonymus 1997a; Connolly 2000a; Siebels 1994]. Meta-analyses van primaire-preventieonderzoeken hebben laten zien dat het positieve effect van een ICD op de overleving het grootst is bij post-myocardinfarctpatiënten met een LVEF ? 35% [Connolly 2000b]. Er zijn minder gegevens over de rol van ICD bij patiënten met niet-ischemische dilaterende cardiomyopathie (DCM) [Kadish 2004, Strickberger 2003, Bänsch 2002. Het SCD-HeFT-onderzoek includeerde patiënten met zowel DCM als ischemische linkerventrikeldisfunctie en liet een reductie van 23% in mortaliteit zien [Bardy 2005]. Een meta-analyse van onderzoeken met alleen niet-ischemische DCM-patiënten liet in de groep patiënten die een ICD ontving een reductie in mortaliteit zien van 25% (p = 0,003) [Desai 2004]. Deze data suggereren dat de etiologie van hartfalen (ischemisch versus niet-ischemisch) verschillen in aanpak van de primaire preventie van plotselinge hartdood mogelijk niet rechtvaardigt.
- Harttransplantatie. Door een chronisch ernstig tekort aan donorharten is harttransplantatie slechts voor enkele patiënten met hartfalen een mogelijke optie. Los van het tekort aan donorharten blijft de belangrijkste uitdaging bij harttransplantatie het voorkómen van afstoting van de allograft. Deze afstoting is verantwoordelijk voor een aanzienlijk percentage sterfgevallen in het eerste jaar na de operatie. De langetermijnuitkomst wordt grotendeels beperkt door de gevolgen van langdurige immunosuppressietherapie (infectie, hypertensie, nierinsufficiëntie, maligniteit en coronarialijden). Harttransplantatie moet worden overwogen bij gemotiveerde patiënten met eindstadium hartfalen, ernstige klachten en verschijnselen, geen ernstige comorbiditeit en geen alternatieve mogelijkheden voor behandeling. Hoewel er geen gecontroleerde onderzoeken zijn uitgevoerd is er toch consensus dat transplantatie bij goede selectie van de patiënt de overleving, inspanningscapaciteit, arbeidsparticipatie en kwaliteit van leven aanzienlijk verbetert in vergelijking tot conventionele therapie.
- Steun- en kunstharten. De technologie van steun- en kunstharten is sterk verbeterd. Hemodynamische ondersteuning met een steunhart zou klinische verslechtering kunnen voorkomen of beperken, en verbetert mogelijk de klinische conditie van de patiënt voorafgaand aan transplantatie. Ook zou het gebruik van het steunhart de mortaliteit van patiënten met ernstige acute myocarditis kunnen verminderen. Tijdens langduriger gebruik van de ondersteuning neemt het risico op complicaties, waaronder infectie en embolisatie, toe.
- Noot 45.↲
Klinische classificatie van acuut hartfalen Acuut hartfalen is in het algemeen in een van de volgende klinische categorieën in te delen.
- Verslechterend of gedecompenseerd chronisch hartfalen (perifeer oedeem/stuwing). Meestal is er sprake van toenemende verslechtering van chronisch hartfalen en zijn er tekenen van vochtretentie en longstuwing. Een lage bloeddruk in deze situatie wijst op een slechte prognose.
- Longoedeem. De patiënt presenteert zich met ernstige dyspneu, tachypneu en orthopneu met bij auscultatie rhonchi over alle longvelden. Ook pulmonaal piepen (wheezing) wordt vaak waargenomen (‘asthma cardiale’). De arteriële zuurstofsaturatie is, voordat gestart wordt met zuurstoftoediening, meestal < 90%.
- Hypertensief hartfalen. Dit wordt gekenmerkt door klinisch alle tekenen van hartfalen plus hypertensie en veelal een behouden systolische linkerventrikelfunctie. Er zijn tekenen van toegenomen sympathische activiteit met tachycardie en vasoconstrictie. De patiënt is vaak normovolemisch of licht hypervolemisch, en heeft vaak tekenen van longstuwing zonder tekenen van systemische overvulling. De respons op behandeling met vaatverwijders (nitraten) is veelal goed en snel, en de kortetermijnprognose is gunstig.
- Cardiogene shock. Is gedefinieerd als weefselhypoperfusie door hartfalen bij een normale vullingsdruk (‘preload’) en in afwezigheid van relevante ritmestoornissen. De systolische bloeddruk is veelal < 90 mmHg en de urineproductie < 0,5 ml/kg/uur. Hartritmestoornissen komen vaak voor. Symptomen van weefselhypoperfusie en longstuwing ontwikkelen zich snel. De kortetermijnprognose is slecht.
- Geïsoleerd rechtszijdig hartfalen (cor pulmonale). Dit wordt gekenmerkt door een ‘low output’-syndroom in afwezigheid van longstuwing maar met een verhoogde CVD (gemeten in de vena jugularis). Pulmonale hypertensie (idiopathisch, door zeer ernstig COPD of multipele longembolieën) is de reden voor decompensatie van de rechter ventrikel. Van alle gevallen van hartfalen wordt ongeveer 1% veroorzaakt door geïsoleerd rechtzijdig hartfalen (cor pulmonale) [Naeije 2005].
- Acuut coronair syndroom (ACS) en hartfalen. Veel patiënten met acuut hartfalen presenteren zich met een klinisch beeld passend bij een ACS. Ongeveer 15% van alle patiënten met een ACS heeft tekenen van hartfalen. Acuut hartfalen bij patiënten met een ACS is vaak geassocieerd met een ritmestoornis (bradycardie, atriumfibrilleren, ventriculaire tachycardie).
- Noot 46.↲
Oorzaken van acuut hartfalen Oorzaken van acuut hartfalen kunnen zijn: ischemie, hartritmestoornissen, klepdisfunctie, pericardaandoeningen, verhoogde vullingsdrukken of een verhoogde perifere weerstand. Combinaties van deze oorzaken komen nogal eens voor. Tabel 7 geeft een opsomming van veel voorkomende oorzaken en luxerende factoren van acuut hartfalen. Het is van doorslaggevend belang om het behandelplan hierop af te stemmen. Veel cardiovasculaire en niet-cardiovasculaire aandoeningen kunnen acuut hartfalen luxeren, bijvoorbeeld: 1) toegenomen ‘afterload’ door systemische of pulmonale hypertensie; 2) toegenomen ‘preload’ door vochtretentie en hypervolemie; en 3) circulatiefalen door ‘high output’ bij infecties, anemie of thyreotoxicose. Andere omstandigheden die aanleiding kunnen geven tot acuut hartfalen zijn slechte therapietrouw, gebruik van geneesmiddelen zoals NSAID’s, COX-2-remmers, thiazolidinedionen of corticosteroïden (zie tabel 7). [[tbl:2968]]
- Noot 47.↲
Prognose van acuut hartfalen Er zijn gegevens beschikbaar uit observationeel prospectief onderzoek en uit dwarsdoorsnedeonderzoek, zoals de EuroHeart Failure Survey II [Nieminen 2006], de ADHERE-‘registry’ in de Verenigde Staten [Gheorghiade 2005a; Gheorghiade 2005b; Yancy 2006] en nationale onderzoeken in Italië [Tavazzi 2006], Frankrijk [Zannad 2006], en Finland [Siirila-Waris 2006]. Veel van de patiënten in deze onderzoeken waren ouderen met aanzienlijke comorbiditeit en een slechte prognose. ACS is de meest voorkomende oorzaak van ‘de novo’ acuut hartfalen. De ziekenhuissterfte is het hoogst bij patiënten met cardiogene shock (40-60%). Patiënten met hypertensief acuut hartfalen daarentegen hebben de laagste ziekenhuissterfte. Bijna de helft van de patiënten wordt na ontslag binnen een jaar opnieuw opgenomen met acuut hartfalen. De prognostische indicatoren zijn hetzelfde als bij chronisch hartfalen [Fonarow 2005]. Een verhoogd troponine bij acuut hartfalen is prognostisch ongunstig [Maisel 2006].
- Noot 48.↲
lntraveneuze lisdiuretica bij acuut hartfalen Het duidelijke symptomatische effect en de wijdverbreide acceptatie van de werkzaamheid hebben de formele evaluatie van diuretica bij hartfalen in grote gerandomiseerde onderzoeken in de weg gestaan [Channer 1994; Cotter 1998; Jhund 2000; Pivac 1998].
Toepassing De aanbevolen startdosis is een bolus van 20-40 mg furosemide of 0,5-1 mg bumetanide i.v. Frequente controle van de urineproductie gedurende de eerste uren is nodig. Bij patiënten met tekenen van overvulling is een hogere dosis furosemide nodig, afhankelijk van de nierfunctie en chronisch diureticagebruik in de voorafgaande periode. Ook kan na de startdosis continue toediening per infuus worden overwogen.
Combinatie met andere diuretica Bij diureticaresistentie is de combinatie van lisdiuretica met thiazides vaak wel effectief. Bij acuut hartfalen met overvulling zijn thiazides (hydrochloorthiazide) en aldosteronantagonisten nuttige toevoegingen aan lisdiuretica. Combinatietherapie met lage doseringen is vaak effectiever dan monotherapie met lisdiuretica in hoge doseringen.
- Noot 49.↲
Vaatverwijders bij acuut hartfalen [Elkayam 2004; Moazemi 2003]
- Vaatverwijders verminderen longstuwing bij acuut hartfalen zonder het slagvolume of de zuurstofbehoefte van het hart ongunstig te beïnvloeden, in het bijzonder bij patiënten met ACS.
- Calciumantagonisten worden niet aanbevolen als vaatverwijder bij acuut hartfalen.
- Vaatverwijders zijn gecontra-indiceerd bij een systolische bloeddruk < 90 mmHg omdat de weefselperfusie te sterk kan verminderen.
- Hypotensie moet vermeden worden met name bij patiënten met nierfunctiestoornissen.
- Bij patiënten met een aortastenose kan (intraveneuze) toediening van vaatverwijders ernstige hypotensie tot gevolg hebben.
Toepassing Nitraten (nitroglycerine, isosorbidedinitraat en isosorbidemononitraat) worden oromucosaal toegepast en in het ziekenhuis als intraveneuze infusie. Nitroglycerine wordt het meest toegepast bij acuut hartfalen en geeft vooral veneuze vasodilatatie. Intraveneus nitroprusside is een krachtige vaatverwijder met ongeveer evenveel effect op het veneuze en het arteriële vaatbed.
Bijwerkingen Hoofdpijn is een veelvoorkomende bijwerking van nitraten. Nitraattolerantie treedt snel op (24-48 uur) en kan dosisverhoging nodig maken. Hypotensie kan ook voorkomen bij de andere vaatverwijders.
- Noot 50.↲
Morfine bij acuut hartfalen Onderzoek naar het effect van morfine bij acuut hartfalen heeft wisselende resultaten opgeleverd. [Hoffman 1987; Lee 1976; Meine 2005; Peacock 2008].
- Noot 51.↲
Palliatieve zorg Ernstig hartfalen heeft een zeer slechte prognose op korte termijn. In de definitie van de WHO van palliatieve zorg worden vier aandachtsgebieden genoemd: lichamelijke, psychische, sociale en spirituele factoren [WHO 2004]. Een palliatief zorgteam kan bestaan uit een zorgcoördinator, huisarts, cardioloog, hartfalenverpleegkundige/praktijkondersteuner, palliatiespecialist, psycholoog/psychotherapeut, fysiotherapeut, diëtist en geestelijke. De behandeling van de eindfase van hartfalen dient een integraal onderdeel te vormen van hartfalenzorgprogramma’s [Goodlin 2004; Metra 2007; McKinley 2004]. Optimale behandeling van hartfalen blijft ook in de terminale fase cruciaal als onderdeel van de palliatie. Voortdurend is aandacht nodig voor tekenen van overvulling maar ook ondervulling en dreigende benauwdheid. Er is een smalle marge tussen overvulling en ondervulling in de eindfase van hartfalen. Over het algemeen verkiest men dreigende ondervulling boven dreigende overvulling. Ondervulling gaat gepaard met somnolentie door cerebrale hypoperfusie, overvulling met dyspneu door overvulling van de longen. Soms zijn daarvoor hoge doseringen diuretica (eventueel combinaties van verschillende diuretica) nodig. Zeker bij ouderen is in het eindstadium van hartfalen de eetlust sterk verminderd en drinkt de patiënt weinig, waardoor de natrium- en vochtinname vaak gering is en daarmee de behoefte aan diuretica kan afnemen. De Landelijke Eerstelijns Samenwerkings Afspraak Palliatieve zorg biedt aanknopingspunten voor regionale afspraken [Eizenga 2006].
- Noot 52.↲
Hartfalenzorgprogramma’s De inhoud en organisatie van hartfalenzorgprogramma’s variëren thans sterk en worden vaak bepaald door regionale behoeften en initiatieven [Yu 2006; Stewart 2005]. Veel programma’s richten zich vooral op patiënten met hartfalen die een of meer keren opgenomen zijn geweest omdat zij een slechtere prognose hebben en een grotere kans op heropname. Gestructureerde follow-up na ontslag leidt tot langere overleving met minder ernstige hartfalensymptomen dan standaardzorg [De la Porte 2007; Stewart 1999; Stromberg 2003]. Het recente COACH-onderzoek heeft laten zien dat intensievere zorgprogramma’s niet altijd betere resultaten opleveren dan minder intensieve [Jaarsma 2008]. Verscheidene meta-analyses gebaseerd op meer dan 8000 patiënten evalueerden het effect van multidisciplinaire zorgprogramma’s, veelal door verpleegkundigen geleid, met follow-up, patiënteducatie en optimalisering van de medicamenteuze behandeling als belangrijkste interventies. Ziekenhuisheropnames kwamen significant minder vaak voor (RRR 16-21%) [McAlister 2004]. Ook was er een significante mortaliteitsreductie. In het Nederlandse Deal-onderzoek werd dit bevestigd [De la Porte 2007]. Welk soort gestructureerd zorgprogramma optimaal is, is niet bekend. Programma’s vanuit het ziekenhuis en vanuit de thuiszorg lijken beide effectief [Gohler 2006; Khunti 2007]. Huisbezoeken door een verpleegkundige of praktijkondersteuner zijn erg effectief [Roccaforte 2005]. Een recente meta-analyse waarin telefonische ondersteuning werd vergeleken met huisbezoeken suggereerde dat huisbezoeken effectiever zijn in de reductie van de gecombineerde uitkomst ‘mortaliteiten en heropnames’ [Clark 2007]. Regionale omstandigheden zijn medebepalend bij de keuze voor een bepaald soort zorgprogramma. Hartfalenverpleegkundigen en praktijkondersteuners kunnen goed leiding geven aan het geprotocolleerd optitreren van medicatie [Blue 2005]. Ook bij de begeleiding van patiënten met een geïmplanteerde device (CRT of ICD) kunnen zorgprogramma’s en de inzet van verpleegkundigen van nut zijn. Verbeterde toegankelijkheid van zorg door dagelijkse telefonische bereikbaarheid van hartfalenverpleegkundigen kan vertrouwen bieden en stelt patiënten in staat om laagdrempelig klachten en verschijnselen, therapie, bijwerkingen en zelfzorggedrag te bespreken. Adequate patiënteducatie is essentieel [Koelling 2005; Krumholz 2002]. Aanmelden van een patiënt in een zorgprogramma zou kunnen tijdens opname, bij ontslag, kort na ontslag of op verzoek van een huisarts. Begeleiding ‘op afstand’ is een opkomend fenomeen binnen zorgprogramma’s. Het kan een aanwinst zijn voor bepaalde groepen patiënten die met de conventionele monitoring onvoldoende kunnen worden begeleid. Telefonische ondersteuning is een vorm van begeleiding op afstand die kan worden aangeboden in de vorm van geplande opbelafspraken of als service waarbij de patiënt zelf kan bellen met vragen over klachten en verschijnselen, verslechtering, bijwerkingen enzovoort. ‘Telemonitoring’ is een andere vorm van begeleiding op afstand waarbij symptomen en onderzoeksbevindingen, gemeten door thuiszorgverleners, familie of de patiënt zelf, systematisch worden doorgegeven aan een professional uit de zorgketen die deze gegevens kan interpreteren en zo nodig de juiste actie kan ondernemen. Door frequent meetgegevens door te geven kunnen patiënten thuis intensief gemonitord worden. Bijvoorbeeld bloeddruk, hartfrequentie, ecg, zuurstofsaturatie, lichaamsgewicht, medicatie inname en uitleesgegevens van devices komen in aanmerking om van afstand te worden doorgegeven. Zelfs videoconsultatie kan worden overwogen. Er bestaat geen consensus over de gegevensset die bij afstandsbegeleiding de meeste meerwaarde biedt. Nieuwe monitoringapparatuur met gebruikmaking van geavanceerde technologie is in ontwikkeling [Clark 2007], en er bestaan reeds implanteerbare ‘monitoring devices’ die diverse fysiologische parameters en experimenteel ook toenemende longstuwing kunnen detecteren en doorzenden. Van hartrevalidatie is aangetoond dat deze de inspanningstolerantie, het functioneel herstel en het subjectief welbevinden gunstig beïnvloedt, evenals de frequentie van heropnames [Corra 2005]. Precieze inventarisatie van de thuissituatie en de individuele behoeften is essentieel.
Literatuur
- 1.Bij verwijzingen naar NHG-producten: zie http://www.nhg.org.
- 2.Almeida OP, Flicker L. The mind of a failing heart: a systematic review of the association between congestive heart failure and cognitive functioning. Intern Med J 2001;31:290-5.
- 3.Anonymus. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). The CONSENSUS Trial Study Group. N Engl J Med 1987;316:1429-35.
- 4.Anonymus. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators. N Engl J Med 1991;325:293-302.
- 5.Anonymus. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Lancet 1993;342:821-8.
- 6.Anonymus. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. N Engl J Med 1997a;337:1576-83.
- 7.Anonymus. The effect of digoxin on mortality and morbidity in patients with heart failure. The Digitalis Investigation Group. N Engl J Med 1997b;336:525-33.
- 8.Anonymus. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999a;353:2001-7.
- 9.Anonymus. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999b;353:9-13.
- 10.Anonymus. Recommendations for exercise training in chronic heart failure patients. Eur Heart J 2001a;22:125-35.
- 11.Anonymus. A trial of the beta-blocker bucindolol in patients with advanced chronic heart failure. N Engl J Med 2001b;344:1659-67.
- 12.Ahmed A, Waagstein F, Pitt B, White M, Zannad F, Young JB, et al. Effectiveness of digoxin in reducing one-year mortality in chronic heart failure in the Digitalis Investigation Group trial. Am J Cardiol 2009;103:82-7.
- 13.Alpert MA, Terry BE, Mulekar M, Cohen MV, Massey CV, Fan TM, et al. Cardiac morphology and left ventricular function in normotensive morbidly obese patients with and without congestive heart failure, and effect of weight loss. Am J Cardiol 1997;80:736-40.
- 14.American Heart Association. AHA medical/scientific statement. 1994 revisions to classification of functional capacity and objective assessment of patients with diseases of the heart. Circulation 1994;90:644-5.
- 15.Anker SD, Ponikowski P, Varney S, Chua TP, Clark AL, Webb-Peploe KM, et al. Wasting as independent risk factor for mortality in chronic heart failure. Lancet 1997;349:1050-3.
- 16.Anker SD, Negassa A, Coats AJ, Afzal R, Poole-Wilson PA, Cohn JN, et al. Prognostic importance of weight loss in chronic heart failure and the effect of treatment with angiotensin-converting-enzyme inhibitors: an observational study. Lancet 2003;361:1077-83.
- 17.Au DH, Udris EM, Fan VS, Curtis JR, McDonell MB, Fihn SD. Risk of mortality and heart failure exacerbations associated with inhaled beta-adrenoceptor agonists among patients with known left ventricular systolic dysfunction. Chest 2003;123:1964-9.
- 18.Au DH, Udris EM, Curtis JR, McDonell MB, Fihn SD. Association between chronic heart failure and inhaled beta-2-adrenoceptor agonists. Am Heart J 2004;148:915-20.
- 19.Badgett RG, Mulrow CD, Otto PM, Ramirez G. How well can the chest radiograph diagnose left ventricular dysfunction? J Gen Intern Med 1996;11:625-34.
- 20.Badgett RG, Lucey CR, Mulrow CD. Can the clinical examination diagnose left-sided heart failure in adults? JAMA 1997;277:1712-9.
- 21.Bänsch D, Antz M, Boczor S, Volkmer M, Tebbenjohanns J, Seidl K, et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation 2002;105:1453-8.
- 22.Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De MT, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004;350:2140-50.
- 23.Bradley TD, Logan AG, Kimoff RJ, Series F, Morrison D, Ferguson K, et al. Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005;353:2025-33.
- 24.Bennett SJ, Sauve MJ. Cognitive deficits in patients with heart failure: a review of the literature. J Cardiovasc Nurs 2003;18:219-42.
- 25.Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005;352:225-37.
- 26.Bhatia RS, Tu JV, Lee DS, Austin PC, Fang J, Haouzi A, et al. Outcome of heart failure with preserved ejection fraction in a population-based study. N Engl J Med 2006;355:260-9.
- 27.Bleumink GS, Knetsch AM, Sturkenboom MC, Straus SM, Hofman A, Deckers JW, et al. Quantifying the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure The Rotterdam Study. Eur Heart J 2004;25:1614-9.
- 28.Blue L, McMurray J. How much responsibility should heart failure nurses take? Eur J Heart Fail 2005;7:351-61.
- 29.Boode BSP, Heeringa J, Konings KTS, Rutten FH, Van den Berg PJ, Zwietering PJ, et al. NHG-Standaard Atriumfibrilleren. Eerste herziening. Huisarts Wet 2009;52:646-63.
- 30.Borst JGG, Molhuysen JA. Exact determination of the central venous pressure by a simple clinical method. Lancet 1952;2:304-9.
- 31.Bouvy ML, Heerdink ER, De Bruin ML, Herings RM, Leufkens HG, Hoes AW. Use of sympathomimetic drugs leads to increased risk of hospitalization for arrhythmias in patients with congestive heart failure. Arch Intern Med 2000;160:2477-80.
- 32.CBO Kwaliteitsinstituut voor de Gezondheidszorg. Multidisciplinaire richtlijn Hartfalen. Utrecht: CBO/NHS/NVVC, 2002. http://www.cbo.nl, geraadpleegd september 2009.
- 33.CBO Kwaliteitsinstituut voor de Gezondheidszorg. Multidisciplinaire richtlijn Cardiovasculair risicomanagement. Van Zuiden Communications, Alphen a/d Rijn, 2006. http://www.cbo.nl, geraadpleegd september 2009.
- 34.Channer KS, McLean KA, Lawson-Matthew P, Richardson M. Combination diuretic treatment in severe heart failure: a randomised controlled trial. Br Heart J 1994;71:146-50.
- 35.Chen AA, Wood MJ, Krauser DG, Baggish AL, Tung R, Anwaruddin S, et al. NT-proBNP levels, echocardiographic findings, and outcomes in breathless patients: results from the ProBNP Investigation of Dyspnoea in the Emergency Department (PRIDE) echocardiographic substudy. Eur Heart J 2006;27:839-45.
- 36.Clark RA, Inglis SC, McAlister FA, Cleland JG, Stewart S. Telemonitoring or structured telephone support programmes for patients with chronic heart failure: systematic review and meta-analysis. BMJ 2007;334:942.
- 37.Cleland JG, Findlay I, Jafri S, Sutton G, Falk R, Bulpitt C, et al. The Warfarin/Aspirin Study in Heart failure (WASH): a randomized trial comparing antithrombotic strategies for patients with heart failure. Am Heart J 2004;148:157-64.
- 38.Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005;352:1539-49.
- 39.Cleland JG, Tendera M, Adamus J, Freemantle N, Polonski L, Taylor J. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006;27:2338-45.
- 40.Cohn JN, Johnson G, Ziesche S, Cobb F, Francis G, Tristani F, et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991;325:303-10.
- 41.Cohn JN, Fowler MB, Bristow MR, Colucci WS, Gilbert EM, Kinhal V et al. Safety and efficacy of carvedilol in severe heart failure. The U.S. Carvedilol Heart Failure Study Group. J Card Fail 1997;3:173-9.
- 42.Cohn JN, Tognoni G. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med 2001;345:1667-75.
- 43.Connolly SJ, Gent M, Roberts RS, Dorian P, Roy D, Sheldon RS, et al. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000a;101:1297-302.
- 44.Connolly SJ, Hallstrom AP, Cappato R, Schron EB, Kuck KH, Zipes DP, et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000b;21:2071-8.
- 45.Corra U, Giannuzzi P, Adamopoulos S, Bjornstad H, Bjarnason-Weherns B, Cohen-Solal A, et al. Executive summary of the position paper of the Working Group on Cardiac Rehabilitation and Exercise Physiology of the European Society of Cardiology (ESC): core components of cardiac rehabilitation in chronic heart failure. Eur J Cardiovasc Prev Rehabil 2005;12:321-5.
- 46.Cotter G, Metzkor E, Kaluski E, Faigenberg Z, Miller R, Simovitz A, et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet 1998;351:389-93.
- 47.Cowie MR, Mosterd A, Wood DA, Deckers JW, Poole-Wilson PA, Sutton GC, et al. The epidemiology of heart failure. Eur Heart J 1997;18:208-25.
- 48.Davie AP, Francis CM, Love MP, Caruana L, Starkey IR, Shaw TR, et al. Value of the electrocardiogram in identifying heart failure due to left ventricular systolic dysfunction. BMJ 1996;312:222.
- 49.Davie AP, Francis CM, Caruana L, Sutherland GR, McMurray JJ. Assessing diagnosis in heart failure: which features are any use? QJM 1997;90:335-9.
- 50.De Grauw WJC, Kaasjager HAH, Bilo HJG, Faber EF, Flikweert S, Gaillard CAJM, et al. Landelijke Transmurale Afspraak Chronische nierschade. Huisarts Wet 2009;52:586-97.
- 51.De la Porte PW, Lok DJ, Van Veldhuisen DJ, Van Wijngaarden J, Cornel JH, Zuithoff NP, et al. Added value of a physician-and-nurse-directed heart failure clinic: results from the Deventer-Alkmaar heart failure study. Heart 2007;93:819-25.
- 52.Desai AS, Fang JC, Maisel WH, Baughman KL. Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA 2004;292:2874-9.
- 53.Dickstein K, Kjekshus J. Effects of losartan and captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Optimal Trial in Myocardial Infarction with Angiotensin II Antagonist Losartan. Lancet 2002;360:752-60.
- 54.Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJ, Ponikowski P, Poole-Wilson PA, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail 2008;10:933-89. http://www.escardio.org/guidelines-surveys/esc-guidelines/Pages/acute-chronic-heart-failure.aspx, geraadpleegd mei 2010.
- 55.Doust JA, Glasziou PP, Pietrzak E, Dobson AJ. A systematic review of the diagnostic accuracy of natriuretic peptides for heart failure. Arch Intern Med 2004;164:1978-84.
- 56.Egred M, Shaw S, Mohammad B, Waitt P, Rodrigues E. Under-use of beta-blockers in patients with ischaemic heart disease and concomitant chronic obstructive pulmonary disease. QJM 2005;98:493-7.
- 57.Eizenga WH, De Bont M, Vriezen JA, Jobse AP, Kruyt ML, Van den Muijsenbergh M. Landelijke Eerstelijns Samenwerkings Afspraak Palliatieve zorg. Huisarts Wet 2006;49:308-12.
- 58.Ekman I, Cleland JG, Swedberg K, Charlesworth A, Metra M, Poole-Wilson PA. Symptoms in patients with heart failure are prognostic predictors: insights from COMET. J Card Fail 2005;11:288-92.
- 59.Elkayam U, Bitar F, Akhter MW, Khan S, Patrus S, Derakhshani M. Intravenous nitroglycerin in the treatment of decompensated heart failure: potential benefits and limitations. J Cardiovasc Pharmacol Ther 2004;9:227-41.
- 60.Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2008;29:270-6.
- 61.Evangelista LS, Dracup K. A closer look at compliance research in heart failure patients in the last decade. Prog Cardiovasc Nurs 2000;15:97-103.
- 62.Fang MC, Go AS, Chang Y, Borowsky L, Pomernacki NK, Singer DE. Comparison of risk stratification schemes to predict thromboembolism in people with nonvalvular atrial fibrillation. J Am Coll Cardiol 2008;51:810-5.
- 63.Faris R, Flather M, Purcell H, Henein M, Poole-Wilson P, Coats A. Current evidence supporting the role of diuretics in heart failure: a meta analysis of randomised controlled trials. Int J Cardiol 2002;82:149-58.
- 64.Felker GM, Adams KF Jr, Gattis WA, O’Connor CM. Anemia as a risk factor and therapeutic target in heart failure. J Am Coll Cardiol 2004;44:959-66.
- 65.Flather MD, Shibata MC, Coats AJ, Van Veldhuisen DJ, Parkhomenko A, Borbola J, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005;26:215-25.
- 66.Flynn KE, Pina IL, Whellan DJ, Lin L, Blumenthal JA, Ellis SJ, et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1451-9.
- 67.Fonarow GC, Adams KF, Jr., Abraham WT, Yancy CW, Boscardin WJ. Risk stratification for in-hospital mortality in acutely decompensated heart failure: classification and regression tree analysis. JAMA 2005;293:572-80.
- 68.Fox KF, Cowie MR, Wood DA, Coats AJ, Gibbs JS, Underwood SR, et al. Coronary artery disease as the cause of incident heart failure in the population. Eur Heart J 2001;22:228-36.
- 69.Freedland KE, Rich MW, Skala JA, Carney RM, Vila-Roman VG, Jaffe AS. Prevalence of depression in hospitalized patients with congestive heart failure. Psychosom Med 2003;65:119-28.
- 70.Fruhwald FM, Fahrleitner-Pammer A, Berger R, Leyva F, Freemantle N, Erdmann E, et al. Early and sustained effects of cardiac resynchronization therapy on N-terminal pro-B-type natriuretic peptide in patients with moderate to severe heart failure and cardiac dyssynchrony. Eur Heart J 2007;28:1592-7.
- 71.Fuat A, Murphy JJ, Hungin AP, Curry J, Mehrzad AA, Hetherington A, et al. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract 2006;56:327-33.
- 72.Gage BF, Van Walraven C, Pearce L, Hart RG, Koudstaal PJ, Boode BS, et al. Selecting patients with atrial fibrillation for anticoagulation: stroke risk stratification in patients taking aspirin. Circulation 2004;110:2287-92.
- 73.Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: the ADHERE Registry. Eur Heart J 2005a;7:B13-B19.
- 74.Gheorghiade M, Zannad F, Sopko G, Klein L, Pina IL, Konstam MA, et al. Acute heart failure syndromes: current state and framework for future research. Circulation 2005b;112:3958-68.
- 75.Gheorghiade M, Sopko G, De Luca L, Velazquez EJ, Parker JD, Binkley PF, et al. Navigating the crossroads of coronary artery disease and heart failure. Circulation 2006;114:1202-13.
- 76.Gohler A, Januzzi JL, Worrell SS, Osterziel KJ, Gazelle GS, Dietz R, et al. A systematic meta-analysis of the efficacy and heterogeneity of disease management programs in congestive heart failure. J Card Fail 2006;12:554-67.
- 77.Goodlin SJ, Hauptman PJ, Arnold R, Grady K, Hershberger RE, Kutner J, et al. Consensus statement: Palliative and supportive care in advanced heart failure. J Card Fail 2004;10:200-9.
- 78.Gosker HR, Lencer NH, Franssen FM, Van der Vusse GJ, Wouters EF, Schols AM. Striking similarities in systemic factors contributing to decreased exercise capacity in patients with severe chronic heart failure or COPD. Chest 2003;123:1416-24.
- 79.Gottlieb SS, Kop WJ, Thomas SA, Katzen S, Vesely MR, Greenberg N, et al. A double-blind placebo-controlled pilot study of controlled-release paroxetine on depression and quality of life in chronic heart failure. Am Heart J 2007;153:868-73.
- 80.Graham I, Atar D, Borch-Johnsen K, Boysen G, Burell G, Cifkova R, et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Eur Heart J 2007;28:2375-414.
- 81.Granger CB, McMurray JJ, Yusuf S, Held P, Michelson EL, Olofsson B, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003;362:772-6.
- 82.Granger BB, Swedberg K, Ekman I, Granger CB, Olofsson B, McMurray JJ, et al. Adherence to candesartan and placebo and outcomes in chronic heart failure in the CHARM programme: doubleblind, randomised, controlled clinical trial. Lancet 2005;366:2005-11.
- 83.Gustafsson F, Steensgaard-Hansen F, Badskjaer J, Poulsen AH, Corell P, Hildebrandt P. Diagnostic and prognostic performance of N-terminal ProBNP in primary care patients with suspected heart failure. J Card Fail 2005;11:S15-S20.
- 84.Haworth JE, Moniz-Cook E, Clark AL, Wang M, Waddington R, Cleland JG. Prevalence and predictors of anxiety and depression in a sample of chronic heart failure patients with left ventricular systolic dysfunction. Eur J Heart Fail 2005;7:803-8.
- 85.Hjalmarson A, Goldstein S, Fagerberg B, Wedel H, Waagstein F, Kjekshus J, et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA 2000;283:1295-302.
- 86.Hoes AW, Mosterd A, Rutten FH, Poos MJJC. Hoe vaak komt hartfalen voor en hoeveel mensen sterven eraan? In: Volksgezondheid Toekomst Verkenning, Nationaal Kompas Volksgezondheid. Bilthoven: RIVM, 2009.
- 87.Hoffman JR, Reynolds S. Comparison of nitroglycerin, morphine and furosemide in treatment of presumed pre-hospital pulmonary edema. Chest 1987;92:586-93.
- 88.Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. ACC/AHA 2005 Guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society. Circulation 2005;112:e154-e235.
- 89.Jaarsma T, Stromberg A, Martensson J, Dracup K. Development and testing of the European Heart Failure Self-Care Behaviour Scale. Eur J Heart Fail 2003;5:363-70.
- 90.Jaarsma T, Van der Wal MH, Lesman-Leegte I, Luttik ML, Hogenhuis J, Veeger NJ, et al. Effect of moderate or intensive disease management program on outcome in patients with heart failure: Coordinating Study Evaluating Outcomes of Advising and Counseling in Heart Failure (COACH). Arch Intern Med 2008;168:316-24.
- 91.Jacob S, Spinler SA. Hyponatremia associated with selective serotonin-reuptake inhibitors in older adults. Ann Pharmacother 2006;40:1618-22.
- 92.Januzzi JL, Van Kimmenade R, Lainchbury J, Bayes-Genis A, Ordonez-Llanos J, Santalo-Bel M, et al. NT-proBNP testing for diagnosis and short-term prognosis in acute destabilized heart failure: an international pooled analysis of 1256 patients: the International Collaborative of NT-proBNP Study. Eur Heart J 2006;27:330-7.
- 93.Javaheri S, Shukla R, Zeigler H, Wexler L. Central sleep apnea, right ventricular dysfunction, and low diastolic blood pressure are predictors of mortality in systolic heart failure. J Am Coll Cardiol 2007;49:2028-34.
- 94.Jhund PS, McMurray JJ, Davie AP. The acute vascular effects of frusemide in heart failure. Br J Clin Pharmacol 2000;50:9-13.
- 95.Jourdain P, Jondeau G, Funck F, Gueffet P, Le HA, Donal E, et al. Plasma brain natriuretic peptide-guided therapy to improve outcome in heart failure: the STARS-BNP Multicenter Study. J Am Coll Cardiol 2007;49:1733-9.
- 96.Juurlink DN, Mamdani MM, Lee DS, Kopp A, Austin PC, Laupacis A, et al. Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med 2004;351:543-51.
- 97.Kadish A, Dyer A, Daubert JP, Quigg R, Estes NA, Anderson KP, et al. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004;350:2151-8.
- 98.Khunti K, Squire I, Abrams KR, Sutton AJ. Accuracy of a 12-lead electrocardiogram in screening patients with suspected heart failure for open access echocardiography: a systematic review and meta-analysis. Eur J Heart Fail 2004;6:571-6.
- 99.Khunti K, Stone M, Paul S, Baines J, Gisborne L, Farooqi A, et al. Disease management programme for secondary prevention of coronary heart disease and heart failure in primary care: a cluster randomised controlled trial. Heart 2007;93:1398-405.
- 100.Kjekshus J, Apetrei E, Barrios V, Bohm M, Cleland JG, Cornel JH, et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007;357:2248-61.
- 101.Kober L, Torp-Pedersen C, Carlsen JE, Bagger H, Eliasen P, Lyngborg K, et al. A clinical trial of the angiotensin-converting-enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. Trandolapril Cardiac Evaluation (TRACE) Study Group. N Engl J Med 1995;333:1670-6.
- 102.Koelling TM, Johnson ML, Cody RJ, Aaronson KD. Discharge education improves clinical outcomes in patients with chronic heart failure. Circulation 2005;111:179-85.
- 103.Koenig HG. Recognition of depression in medical patients with heart failure. Psychosomatics 2007;48:338-47.
- 104.Kostis JB, Jackson G, Rosen R, Barrett-Connor E, Billups K, Burnett AL, et al. Sexual dysfunction and cardiac risk (the Second Princeton Consensus Conference). Am J Cardiol 2005;96:85M-93M.
- 105.Krishnaswamy P, Lubien E, Clopton P, Koon J, Kazanegra R, Wanner E, et al. Utility of B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction. Am J Med 2001;111:274-9.
- 106.Krumholz HM, Amatruda J, Smith GL, Mattera JA, Roumanis SA, Radford MJ, et al. Randomized trial of an education and support intervention to prevent readmission of patients with heart failure. J Am Coll Cardiol 2002;39:83-9.
- 107.Kujala UM. Evidence for exercise therapy in the treatment of chronic disease based on at least three randomized controlled trials--summary of published systematic reviews. Scand J Med Sci Sports 2004;14:339-45.
- 108.Lader E, Egan D, Hunsberger S, Garg R, Czajkowski S, McSherry F. The effect of digoxin on the quality of life in patients with heart failure. J Card Fail 2003;9:4-12.
- 109.Lainscak M, Cleland JG, Lenzen MJ, Nabb S, Keber I, Follath F, et al. Recall of lifestyle advice in patients recently hospitalised with heart failure: a EuroHeart Failure Survey analysis. Eur J Heart Fail 2007;9:1095-103.
- 110.Lane DA, Chong AY, Lip GY. Psychological interventions for depression in heart failure. Cochrane Database Syst Rev 2005;CD003329.
- 111.Le Jemtel TH, Padeletti M, Jelic S. Diagnostic and therapeutic challenges in patients with coexistent chronic obstructive pulmonary disease and chronic heart failure. J Am Coll Cardiol 2007;49:171-80.
- 112.Lee G, DeMaria AN, Amsterdam EA, Realyvasquez F, Angel J, Morrison S, et al. Comparative effects of morphine, meperidine and pentazocine on cardiocirculatory dynamics in patients with acute myocardial infarction. Am J Med 1976;60:949-55.
- 113.Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA 1996;275:1557-62.
- 114.Lewin J, Ledwidge M, O’Loughlin C, McNally C, McDonald K. Clinical deterioration in established heart failure: what is the value of BNP and weight gain in aiding diagnosis? Eur J Heart Fail 2005;7:953-7.
- 115.Lip GY, Boos CJ. Antithrombotic treatment in atrial fibrillation. Heart 2006;92:155-61.
- 116.Lloyd-Jones DM, Larson MG, Leip EP, Beiser A, D’Agostino RB, Kannel WB, et al. Lifetime risk for developing congestive heart failure: the Framingham Heart Study. Circulation 2002;106:3068-72.
- 117.Loeb HS, Johnson G, Henrick A, Smith R, Wilson J, Cremo R, et al. Effect of enalapril, hydralazine plus isosorbide dinitrate, and prazosin on hospitalization in patients with chronic congestive heart failure. The V-HeFT VA Cooperative Studies Group. Circulation 1993;87:VI78-VI87.
- 118.Macchia A, Monte S, Romero M, D’Ettorre A, Tognoni G. The prognostic influence of chronic obstructive pulmonary disease in patients hospitalised for chronic heart failure. Eur J Heart Fail 2007;9:942-8.
- 119.Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002;347:161-7.
- 120.Maisel AS, Bhalla V, Braunwald E. Cardiac biomarkers: a contemporary status report. Nat Clin Pract Cardiovasc Med 2006;3:24-34.
- 121.Mancini DM, Katz SD, Lang CC, LaManca J, Hudaihed A, Androne AS. Effect of erythropoietin on exercise capacity in patients with moderate to severe chronic heart failure. Circulation 2003;107:294-9.
- 122.Mariotti R, Castrogiovanni F, Canale ML, Borelli G, Rondinini L. Weight loss and quality of life in chronic heart failure patients. J Cardiovasc Med (Hagerstown) 2008;9:576-80.
- 123.Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008;359:2456-67.
- 124.McAlister FA, Stewart S, Ferrua S, McMurray JJ. Multidisciplinary strategies for the management of heart failure patients at high risk for admission: a systematic review of randomized trials. J Am Coll Cardiol 2004;44:810-9.
- 125.McKinley RK, Stokes T, Exley C, Field D. Care of people dying with malignant and cardiorespiratory disease in general practice. Br J Gen Pract 2004;54:909-913.
- 126.McMurray JJ, Ostergren J, Swedberg K, Granger CB, Held P, Michelson EL, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003;362:767-71.
- 127.McMurray JJ, Pfeffer MA, Swedberg K, Dzau VJ. Which inhibitor of the renin-angiotensin system should be used in chronic heart failure and acute myocardial infarction? Circulation 2004;110:3281-8.
- 128.McMurray J, Cohen-Solal A, Dietz R, Eichhorn E, Erhardt L, Hobbs FD, et al. Practical recommendations for the use of ACE inhibitors, beta-blockers, aldosterone antagonists and angiotensin receptor blockers in heart failure: putting guidelines into practice. Eur J Heart Fail 2005;7:710-21.
- 129.Meine TJ, Roe MT, Chen AY, Patel MR, Washam JB, Ohman EM, et al. Association of intravenous morphine use and outcomes in acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. Am Heart J 2005;149:1043-9.
- 130.Metra M, Ponikowski P, Dickstein K, McMurray JJ, Gavazzi A, Bergh CH, et al. Advanced chronic heart failure: A position statement from the Study Group on Advanced Heart Failure of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2007;9:684-94.
- 131.Ministerie van Verkeer en Waterstaat. Regeling eisen geschiktheid 2000. Regeling van 23 mei 2000, nr. CDJZ/WBI/2000-612, Stcrt. 2000, 99, laatstelijk gewijzigd bij regeling van 16 febuari 2010, Stcrt. 2010, 2588.
- 132.Moazemi K, Chana JS, Willard AM, Kocheril AG. Intravenous vasodilator therapy in congestive heart failure. Drugs Aging 2003;20:485-508.
- 133.Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007;93:1137-46.
- 134.Mueller C, Laule-Kilian K, Scholer A, Frana B, Rodriguez D, Schindler C, et al. Use of B-type natriuretic peptide for the management of women with dyspnea. Am J Cardiol 2004;94:1510-4.
- 135.Nanas JN, Matsouka C, Karageorgopoulos D, Leonti A, Tsolakis E, Drakos SG, et al. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006;48:2485-9.
- 136.Naughton MT. The link between obstructive sleep apnea and heart failure: underappreciated opportunity for treatment. Curr Cardiol Rep 2005;7:211-5.
- 137.Naeije R. Pulmonary hypertension and right heart failure in chronic obstructive pulmonary disease. Proc Am Thorac Soc 2005;2:20-2.
- 138.Nicklas BJ, Cesari M, Penninx BW, Kritchevsky SB, Ding J, Newman A, et al. Abdominal obesity is an independent risk factor for chronic heart failure in older people. J Am Geriatr Soc 2006;54:413-20.
- 139.Nicolas JM, Fernandez-Sola J, Estruch R, Pare JC, Sacanella E, Urbano-Marquez A, et al. The effect of controlled drinking in alcoholic cardiomyopathy. Ann Intern Med 2002;136:192-200.
- 140.Nielsen OW, Hansen JF, Hilden J, Larsen CT, Svanegaard J. Risk assessment of left ventricular systolic dysfunction in primary care: cross sectional study evaluating a range of diagnostic tests. BMJ 2000;320:220-4.
- 141.Nielsen LS, Svanegaard J, Klitgaard NA, Egeblad H. N-terminal pro-brain natriuretic peptide for discriminating between cardiac and non-cardiac dyspnoea. Eur J Heart Fail 2004;6:63-70.
- 142.Nieminen MS, Brutsaert D, Dickstein K, Drexler H, Follath F, Harjola VP, et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J 2006;27:2725-36.
- 143.Nederlandse Internisten Vereniging. Richtlijnen elektrolytstoornissen. Alphen a/d Rijn: Van Zuiden communications, 2005. http://www.internisten.nl/, geraadpleegd mei 2010.
- 144.NYHA. Heart Failure Society of America (HFSA) practice guidelines. HFSA guidelines for management of patients with heart failure caused by left ventricular systolic dysfunction--pharmacological approaches. J Card Fail 1999;5:357-82.
- 145.O’Connor CM, Whellan DJ, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1439-50.
- 146.Okonko DO, Grzeslo A, Witkowski T, Mandal AK, Slater RM, Roughton M, et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol 2008;51:103-12.
- 147.Oldenburg O, Lamp B, Faber L, Teschler H, Horstkotte D, Topfer V. Sleep-disordered breathing in patients with symptomatic heart failure: a contemporary study of prevalence in and characteristics of 700 patients. Eur J Heart Fail 2007;9:251-7.
- 148.Opasich C, Cazzola M, Scelsi L, De Feo S, Bosimini E, Lagioia R, et al. Blunted erythropoietin production and defective iron supply for erythropoiesis as major causes of anaemia in patients with chronic heart failure. Eur Heart J 2005;26:2232-7.
- 149.Opatrny L, Delaney JA, Suissa S. Gastro-intestinal haemorrhage risks of selective serotonin receptor antagonist therapy: a new look. Br J Clin Pharmacol 2008;66:76-81.
- 150.Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006;355:251-9.
- 151.Packer M, Poole-Wilson PA, Armstrong PW, Cleland JG, Horowitz JD, Massie BM, et al. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation 1999;100:2312-8.
- 152.Packer M, Coats AJ, Fowler MB, Katus HA, Krum H, Mohacsi P, et al; Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001;344:1651-8.
- 153.Packer M, Fowler MB, Roecker EB, Coats AJ, Katus HA, Krum H, et al. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study. Circulation 2002;106:2194-9.
- 154.Parissis J, Fountoulaki K, Paraskevaidis I, Kremastinos DT. Sertraline for the treatment of depression in coronary artery disease and heart failure. Expert Opin Pharmacother 2007;8:1529-37.
- 155.Patel H, Shafazand M, Schaufelberger M, Ekman I. Reasons for seeking acute care in chronic heart failure. Eur J Heart Fail 2007;9:702-8.
- 156.Paterna S, Parrinello G, Cannizzaro S, Fasullo S, Torres D, Sarullo FM, et al. Medium term effects of different dosage of diuretic, sodium, and fluid administration on neurohormonal and clinical outcome in patients with recently compensated heart failure. Am J Cardiol 2009;103:93-102.
- 157.Paulus WJ, Tschope C, Sanderson JE, Rusconi C, Flachskampf FA, Rademakers FE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007;28:2539-50.
- 158.Peacock WF, Hollander JE, Diercks DB, Lopatin M, Fonarow G, Emerman CL. Morphine and outcomes in acute decompensated heart failure: an ADHERE analysis. Emerg Med J 2008;25:205-9.
- 159.Pereira JJ, Lauer MS, Bashir M, Afridi I, Blackstone EH, Stewart WJ, et al. Survival after aortic valve replacement for severe aortic stenosis with low transvalvular gradients and severe left ventricular dysfunction. J Am Coll Cardiol 2002;39:1356-63.
- 160.Pfeffer MA, Braunwald E, Moye LA, Basta L, Brown EJ Jr, Cuddy TE, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992;327:669-77.
- 161.Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Kober L, Maggioni AP, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med 2003;349:1893-906.
- 162.Piepoli MF, Flather M, Coats AJ. Overview of studies of exercise training in chronic heart failure: the need for a prospective randomized multicentre European trial. Eur Heart J 1998;19:830-41.
- 163.Piepoli MF, Davos C, Francis DP, Coats AJ. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ 2004;328:189.
- 164.Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999;341:709-17.
- 165.Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003;348:1309-21.
- 166.Pivac N, Rumboldt Z, Sardelic S, Bagatin J, Polic S, Ljutic D, et al. Diuretic effects of furosemide infusion versus bolus injection in congestive heart failure. Int J Clin Pharmacol Res 1998;18:121-8.
- 167.Ponikowski P, Anker SD, Szachniewicz J, Okonko D, Ledwidge M, Zymlinski R, et al. Effect of darbepoetin alfa on exercise tolerance in anemic patients with symptomatic chronic heart failure: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol 2007;49:753-62.
- 168.Poole-Wilson PA, Swedberg K, Cleland JG, Di Lenarda A, Hanrath P, Komajda M, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003;362:7-13.
- 169.Poos MJJC, Gijsen R. Prevalentie, incidentie, ziekenhuisopnamen en sterfte naar leeftijd en geslacht. In: Volksgezondheid Toekomst Verkenning, Nationaal Kompas Volksgezondheid. Bilthoven: RIVM, 2006. http://www.nationaalkompas.nl, geraadpleegd mei 2010.
- 170.Rees K, Taylor RS, Singh S, Coats AJ, Ebrahim S. Exercise based rehabilitation for heart failure. Cochrane Database Syst Rev 2004;CD003331.
- 171.Remes J, Miettinen H, Reunanen A, Pyorala K. Validity of clinical diagnosis of heart failure in primary health care. Eur Heart J 1991;12:315-21.
- 172.Revalidatie Commissie van de Nederlandse Vereniging Voor Cardiologie en de Nederlandse Hartstichting. Richtlijn Hartrevalidatie. Den Haag: 2004.
- 173.Rivero-Ayerza M, Theuns DA, Garcia-Garcia HM, Boersma E, Simoons M, Jordaens LJ. Effects of cardiac resynchronization therapy on overall mortality and mode of death: a meta-analysis of randomized controlled trials. Eur Heart J 2006;27:2682-8.
- 174.Roccaforte R, Demers C, Baldassarre F, Teo KK, Yusuf S. Effectiveness of comprehensive disease management programmes in improving clinical outcomes in heart failure patients. A meta-analysis. Eur J Heart Fail 2005;7:1133-44.
- 175.Rutten FH, Walma EP, Kruizinga GI, Bakx HCA, Van Lieshout J. NHG-Standaard Hartfalen, eerste herziening. Huisarts Wet 2005a;48:064-77.
- 176.Rutten FH, Cramer MJ, Grobbee DE, Sachs AP, Kirkels JH, Lammers JW, et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease. Eur Heart J 2005b;26:1887-94.
- 177.Rutten FH, Moons KG, Cramer MJ, Grobbee DE, Zuithoff NP, Lammers JW, et al. Recognising heart failure in elderly patients with stable chronic obstructive pulmonary disease in primary care: cross sectional diagnostic study. BMJ 2005c;10;331(7529):1379.
- 178.Rutten FH, Cramer MJ, Lammers JW, Grobbee DE, Hoes AW. Heart failure and chronic obstructive pulmonary disease: An ignored combination? Eur J Heart Fail 2006;8:706-11.
- 179.Salpeter SS, Ormiston T, Salpeter E, Poole P, Cates C. Cardioselective beta-blockers for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002;CD003566.
- 180.Schalekamp T, Klungel OH, Souverein PC, De Boer A. Increased bleeding risk with concurrent use of selective serotonin reuptake inhibitors and coumarins. Arch Intern Med 2008;168:180-5.
- 181.Schiffer AA, Denollet J, Widdershoven JW, Hendriks EH, Smith OR. Failure to consult for symptoms of heart failure in patients with a type-D personality. Heart 2007;93:814-8.
- 182.Schinkel AF, Poldermans D, Elhendy A, Bax JJ. Assessment of myocardial viability in patients with heart failure. J Nucl Med 2007;48:1135-46.
- 183.Shanmugam G, Legare JF. Revascularization for ischaemic cardiomyopathy. Curr Opin Cardiol 2008;23:148-52.
- 184.Shelton RJ, Rigby AS, Cleland JG, Clark AL. Effect of a community heart failure clinic on uptake of beta blockers by patients with obstructive airways disease and heart failure. Heart 2006;92:331-6.
- 185.Siebels J, Kuck KH. Implantable cardioverter defibrillator compared with antiarrhythmic drug treatment in cardiac arrest survivors (the Cardiac Arrest Study Hamburg). Am Heart J 1994;127:1139-44.
- 186.Siirila-Waris K, Lassus J, Melin J, Peuhkurinen K, Nieminen MS, Harjola VP. Characteristics, outcomes, and predictors of 1-year mortality in patients hospitalized for acute heart failure. Eur Heart J 2006;27:3011-7.
- 187.Sin DD, Man SF. Chronic obstructive pulmonary disease as a risk factor for cardiovascular morbidity and mortality. Proc Am Thorac Soc 2005;2:8-11.
- 188.Singh S, Loke YK, Furberg CD. Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008;300:1439-50.
- 189.Smart N, Marwick TH. Exercise training for patients with heart failure: a systematic review of factors that improve mortality and morbidity. Am J Med 2004;116:693-706.
- 190.Smith GL, Lichtman JH, Bracken MB, Shlipak MG, Phillips CO, DiCapua P, et al. Renal impairment and outcomes in heart failure: systematic review and meta-analysis. J Am Coll Cardiol 2006;47:1987-96.
- 191.Springer J, Filippatos G, Akashi YJ, Anker SD. Prognosis and therapy approaches of cardiac cachexia. Curr Opin Cardiol 2006;21:229-33.
- 192.Statistics Netherlands (CBS). Voorburg. Statline [website]. http://statline.cbs.nl/statweb, geraadpleegd mei 2010.
- 193.Stewart S, Marley JE, Horowitz JD. Effects of a multidisciplinary, home-based intervention on unplanned readmissions and survival among patients with chronic congestive heart failure: a randomised controlled study. Lancet 1999;354:1077-83.
- 194.Stewart S. Financial aspects of heart failure programs of care. Eur J Heart Fail 2005;7:423-8.
- 195.Strickberger SA, Hummel JD, Bartlett TG, Frumin HI, Schuger CD, Beau SL, et al. Amiodarone versus implantable cardioverter-defibrillator:randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia–AMIOVIRT. J Am Coll Cardiol 2003;41:1707-12.
- 196.Stromberg A, Martensson J, Fridlund B, Levin LA, Karlsson JE, Dahlstrom U. Nurse-led heart failure clinics improve survival and self-care behaviour in patients with heart failure: results from a prospective, randomised trial. Eur Heart J 2003;24:1014-23.
- 197.Tang YD, Katz SD. Anemia in chronic heart failure: prevalence, etiology, clinical correlates, and treatment options. Circulation 2006;113:2454-61.
- 198.Tavazzi L, Maggioni AP, Lucci D, Cacciatore G, Ansalone G, Oliva F, et al. Nationwide survey on acute heart failure in cardiology ward services in Italy. Eur Heart J 2006;27:1207-15.
- 199.Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372:1231-9.
- 200.Taylor AL, Ziesche S, Yancy C, Carson P, D’Agostino R Jr, Ferdinand K, et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N Engl J Med 2004;351:2049-57.
- 201.Travers B, O’Loughlin C, Murphy NF, Ryder M, Conlon C, Ledwidge M, et al. Fluid restriction in the management of decompensated heart failure: no impact on time to clinical stability. J Card Fail 2007;13:128-32.
- 202.Troughton RW, Frampton CM, Yandle TG, Espiner EA, Nicholls MG, Richards AM. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (N-BNP) concentrations. Lancet 2000;355:1126-30.
- 203.Vahanian A, Baumgartner H, Bax J, Butchart E, Dion R, Filippatos G, et al. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 2007;28:230-68.
- 204.Van der Lucht F, Polder Jr. Volksgezondheid Toekomst Verkenning 2010. Bilthoven: RIVM, 2010.
- 205.Van der Wal MH, Jaarsma T, Van Veldhuisen DJ. Non-compliance in patients with heart failure; how can we manage it? Eur J Heart Fail 2005;7:5-17.
- 206.Van der Wel MC, Jansen RW, Bakx JC, Bor HH, Olderikkert MG, Van Weel C. Non-cardiovascular co-morbidity in elderly patients with heart failure outnumbers cardiovascular co-morbidity. Eur J Heart Fail 2007;9:709-15.
- 207.Van Kimmenade R, Van Dielen F, Bakker J, Nijhuis J, Crijns H, Buurman W, et al. Is brain natriuretic peptide production decreased in obese subjects? J Am Coll Cardiol 2006;47:886-7.
- 208.Van Tol BA, Huijsmans RJ, Kroon DW, Schothorst M, Kwakkel G. Effects of exercise training on cardiac performance, exercise capacity and quality of life in patients with heart failure: a meta-analysis. Eur J Heart Fail 2006;8:841-50.
- 209.Van Veldhuisen DJ, Dickstein K, Cohen-Solal A, Lok DJ, Wasserman SM, Baker N, et al. Randomized, double-blind, placebo-controlled study to evaluate the effect of two dosing regimens of darbepoetin alfa in patients with heart failure and anaemia. Eur Heart J 2007;28:2208-16.
- 210.Vogels RL, Scheltens P, Schroeder-Tanka JM, Weinstein HC. Cognitive impairment in heart failure: a systematic review of the literature. Eur J Heart Fail 2007a;9:440-9.
- 211.Vogels RL, Oosterman JM, Van Harten B, Scheltens P, Van der Flier WM, Schroeder-Tanka JM, et al. Profile of cognitive impairment in chronic heart failure. J Am Geriatr Soc 2007b;55:1764-70.
- 212.Vogels RL, Van der Flier WM, Van Harten B, Gouw AA, Scheltens P, Schroeder-Tanka JM, et al. Brain magnetic resonance imaging abnormalities in patients with heart failure. Eur J Heart Fail 2007c;9:1003-9.
- 213.Vogels RL, Oosterman JM, Van Harten B, Gouw AA, Schroeder-Tanka JM, Scheltens P, et al. Neuroimaging and correlates of cognitive function among patients with heart failure. Dement Geriatr Cogn Disord 2007d;24:418-23.
- 214.Von Haehling S, Doehner W, Anker SD. Nutrition, metabolism, and the complex pathophysiology of cachexia in chronic heart failure. Cardiovasc Res 2007;73:298-309.
- 215.Wang H, Parker JD, Newton GE, Floras JS, Mak S, Chiu KL, et al. Influence of obstructive sleep apnea on mortality in patients with heart failure. J Am Coll Cardiol 2007;49:1625-31.
- 216.Whellan DJ, O’Connor CM, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Heart failure and a controlled trial investigating outcomes of exercise training (HF-ACTION): design and rationale. Am Heart J 2007;153:201-11.
- 217.WHO. Palliative Care: Symptom management and end-of-life care. Geneva: World Health Organization, 2004 http://www.who.int/hiv/pub/imai/genericpalliativecare082004.pdf, geraadpleegd mei 2010.
- 218.Yamamoto K, Burnett JC, Jr Bermudez EA, Jougasaki M, Bailey KR, Redfield MM. Clinical criteria and biochemical markers for the detection of systolic dysfunction. J Card Fail 2000;6:194-200.
- 219.Yancy CW, Lopatin M, Stevenson LW, De Marco T, Fonarow GC. Clinical presentation, management, and in-hospital outcomes of patients admitted with acute decompensated heart failure with preserved systolic function: a report from the Acute Decompensated Heart Failure National Registry (ADHERE) Database. J Am Coll Cardiol 2006;47:76-84.
- 220.Yu DS, Thompson DR, Lee DT. Disease management programmes for older people with heart failure: crucial characteristics which improve post-discharge outcomes. Eur Heart J 2006;27:596-612.
- 221.Yusuf S, Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJ, et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003;362:777-81.
- 222.Zannad F, Mebazaa A, Juilliere Y, Cohen-Solal A, Guize L, Alla F, et al. Clinical profile, contemporary management and one-year mortality in patients with severe acute heart failure syndromes: The EFICA study. Eur J Heart Fail 2006;8:697-705.
- 223.Zaphiriou A, Robb S, Murray-Thomas T, Mendez G, Fox K, McDonagh T, et al. The diagnostic accuracy of plasma BNP and NT-proBNP in patients referred from primary care with suspected heart failure: results of the UK natriuretic peptide study. Eur J Heart Fail 2005;7:537-41.
Reacties
Er zijn nog geen reacties.